정맥투여만으로 CNS 뇌 조직 siRNA 노출·표적 유전자 억제 정량 데이터 제시
그랩바디-B, 단백질 넘어 올리고뉴클레오타이드까지 확장 가능한 전달 플랫폼 부각
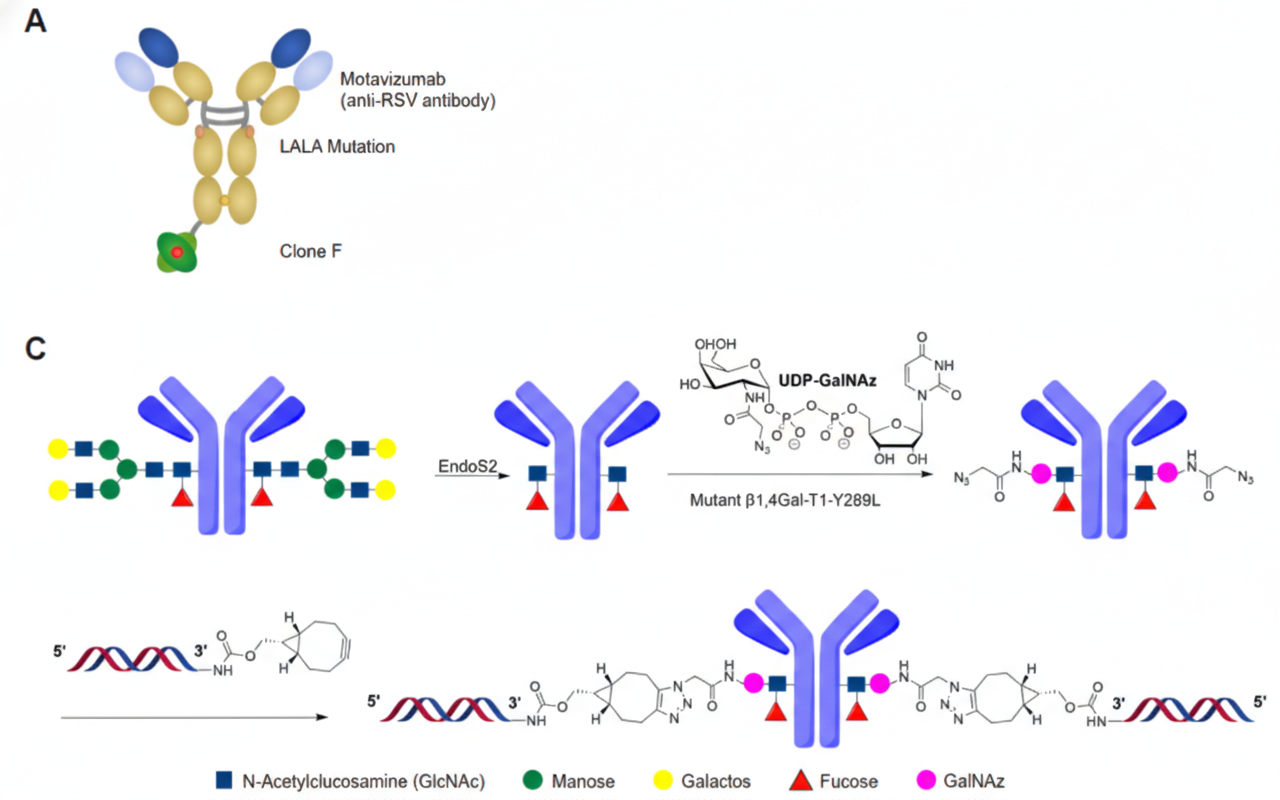
에이비엘바이오의 숨겨둔 비장의 카드가 또 한장 공개됐다. 에이비엘바이오는 미국 아이오니스 파마슈티컬스(Ionis Pharmaceuticals)와 IGF1R 표적 항체 기반 BBB(뇌혈관장벽) 셔틀 ‘그랩바디-B(Grabody-B)’를 siRNA 전달에 적용한 공동연구 결과를 최초로 공개했다.
특히 siRNA 단독 정맥투여로는 확인하기 어려웠던 뇌 조직 내 노출과 표적 유전자 억제 신호를 정량 데이터로 제시했다. ‘뇌에 들어갔다’는 결과에 그치지 않고, 중추신경계(Central nervous system, CNS) 부위별 반응 차이와 투여 경로에 따른 효능 변화, 말단 조직에서의 용량과 반응 관계까지 함께 제시했다.
에이비엘바이오는 2일 아이오니스와 공동으로 수행한 연구 결과를 bioRxiv에 선공개했다. 논문 제목은 ‘항-IGF1R 항체 접합을 통한 CNS 및 말초 조직으로의 siRNA 전신·국소 전달(Systemic and Local Delivery of siRNA to the CNS and Periphery via Anti-IGF1R Antibody Conjugation)’이다.
논문에서는 “이번 결과를 통해 그랩바디-B 기반 siRNA 뇌 전달 전략이 실제로 작동할 수 있음을 뒷받침하는 근거가 정량 데이터로 제시됐다”고 밝혔다.
siRNA 오래된 과제…전신 투여와 CNS 전달 한계
siRNA는 특정 유전자 발현을 직접 억제할 수 있는 모달리티로 주목받아 왔지만, 전달(delivery)은 오랫동안 한계로 여겨져 왔다. siRNA는 혈중 안정성과 조직 침투성이 낮아 전신 투여 시 효율적인 표적 도달이 어렵고, 특히 CNS에서는 BBB로 인해 접근성이 제한됐다.
이 때문에 뇌를 직접 표적 하는 다수의 올리고뉴클레오타이드(oligonucleotide) 타입 치료제들은 여전히 뇌척수액 경로를 통한 직접 투여가 이뤄지고 있다. 뇌실내 투여(ICV)나 척수강내 투여(IT)는 BBB를 우회할 수 있다는 장점이 있지만, 반복 시술에 따른 환자 부담과 시술 관련 합병증 위험이라는 한계를 동시에 안고 있다. 또한 이 방식이 뇌 실질 전반에 균일한 분포를 보장하지 못할 수 있다는 점도 임상 현장에서 지속적으로 제기돼 온 문제다.
이 한계를 극복하기 위해 에이비엘바이오와 아이오니스는 IGF1R을 표적하는 항체 기반 BBB 셔틀 그랩바디-B를 활용해 siRNA를 정맥(IV) 및 피하(SC) 투여했을 때, CNS 전달과 유전자 억제가 가능한지를 검증하고자 했다.
그랩바디-B로 확인한 BBB 셔틀 작동 범위
연구진은 IGF1R을 표적하는 BBB 셔틀 항체 ‘그랩바디-B(논문 표기: Clone F)’에 Hprt 표적 siRNA를 접합한 항체-siRNA 복합체 'Clone F-Hprt'를 제작해 실험을 진행했다.
이번 연구에 사용된 siRNA와 접합(conjugation) 구성은 정밀한 최적화를 거친 상업 단계용이 아닌, 전달 플랫폼의 기본 작동 여부를 확인하기 위한 초기 단계 설계였다. 그럼에도 의미 있는 신호가 관찰됐다.
Hprt 표적 siRNA를 단독으로 10 mg/kg 정맥투여했을 때는 뇌 조직에서 유의미한 억제 효과가 나타나지 않았지만, Clone F-Hprt를 정맥투여한 경우 뇌 조직 내 siRNA 노출과 표적 유전자 Hprt 감소가 함께 관찰됐다.
특히 대뇌 피질에서는 siRNA 단독 정맥투여 시 거의 검출되지 않은 반면, Clone F-Hprt 투여 시 용량 의존적인 노출 증가와 함께 약 30% 수준의 유전자 발현 감소가 확인됐다. 이러한 감소 신호는 대뇌뿐 아니라 선조체와 시상 등 심부 뇌 영역에서도 관찰됐다.
데이터는 IGF1R 표적 항체 셔틀 그랩바디-B를 활용한 정맥투여만으로도 CNS 여러 부위에서 표적 유전자 억제가 가능하다는 것을 보여줬다. 또 전신 투여 기반 siRNA의 CNS 접근 가능성을 뒷받침했다.
"정맥투여로 정말 뇌에 들어갔나”…전달 근거 데이터 확보
연구진은 CNS에서 관찰된 유전자 억제 신호가 실제 뇌 조직 전달에 기반한 결과인지 확인하기 위해 siRNA 조직 노출 데이터를 함께 제시했다.
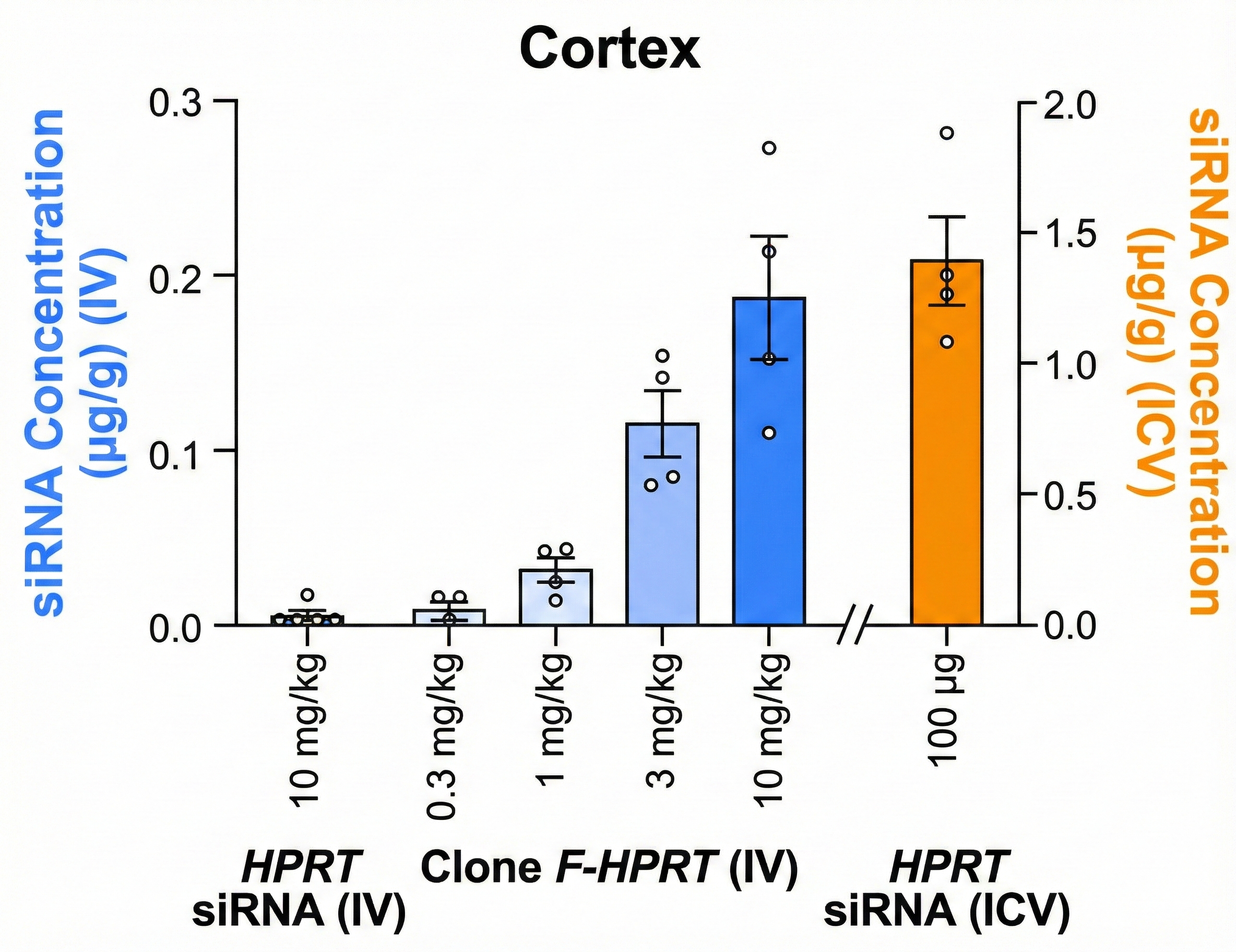
정맥투여 후 대뇌 피질(cortex) 조직에서 siRNA 농도를 정량 분석한 결과, Clone F-Hprt는 0.3 mg/kg 투여 시 약 0.008 µg/g, 10 mg/kg 투여 시 약 0.187 µg/g으로, 용량 증가에 따라 뇌 조직 내 siRNA 노출이 단계적으로 증가하는 양상을 보였다. 반면 Hprt 표적 siRNA를 단독으로 정맥투여한 경우에는 동일 조건에서도 대뇌 조직에서 siRNA 노출이 거의 확인되지 않았다.
이는 siRNA를 뇌실내(ICV)로 직접 투여했을 때의 대뇌 노출 수준(100 µg ICV 투여 시 약 1.388 µg/g)과 비교하면 낮은 수치다. 그러나 정맥투여만으로도 뇌 조직 내 siRNA 농도가 정량적으로 검출됐고, 이에 상응하는 표적 유전자 억제 효과가 함께 관찰됐다는 점은 주목할 만하다.
이번 결과는 에이비엘바이오가 그동안 강조해 온 그랩바디-B의 BBB 셔틀 전략이 단백질 치료제를 넘어, siRNA와 같은 RNA 모달리티로까지 확장될 수 있음을 보여주는 대목이다.
CNS를 넘어 말단 조직까지 ‘전신 전달’
CNS를 넘어 말단 조직에서도 Clone F-Hprt 전달이 정량 데이터로 확인됐다.
정맥투여 10mg/kg 조건에서 Hprt 표적 siRNA를 단독 투여한 경우, 근육(대퇴사두근)에서는 Hprt mRNA 잔존율이 약 53%, 간에서는 약 63% 수준으로 나타났다. 반면 심장, 폐, 신장, 비장 등 다른 말단 조직에서는 유의미한 유전자 억제 효과가 거의 관찰되지 않았다.
Clone F-Hprt를 투여했을 때 결과는 달라졌다. 정맥 및 피하 투여 모두에서 근육, 간, 심장, 폐 등 여러 말단 조직에서 용량 의존적인 유전자 감소 신호가 확인됐다. 정맥투여 10mg/kg 기준으로 근육에서는 mRNA 잔존율이 약 22%, 간 11%, 심장 38%, 폐 62% 수준까지 낮아졌다. 신장과 비장에서는 일관된 Knockdown(유전자 발현 억제) 효과가 확인되지는 않았다.
특히 근육 조직에서는 낮은 용량(0.3 mg/kg)에서도 유전자 억제가 관찰됐다. 조직 내 siRNA 농도에서도 뚜렷한 차이를 보였다. 근육에서 siRNA 단독 정맥투여 시 조직 내 농도는 약 0.19µg/g 수준이었지만, Clone F-Hprt 투여군에서는 약 1.11µg/g으로 약 6배 가까이 높았다.
이 결과는 그랩바디-B 활용은 BBB를 넘는 CNS 전달뿐 아니라, 말단 조직에서 siRNA 노출과 효능까지 함께 끌어올릴 수 있다는 것을 의미한다.
안전성 측면에서도 의미 있는 신호가 관찰됐다. 정맥투여 조건에서 Clone F-Hprt는 siRNA 단독 투여 대비 신장 조직 내 축적이 상대적으로 낮게 나타났다. 해당 데이터만으로 신장 독성 완화를 단정할 수는 없지만, 기존 siRNA 및 소분자 치료제에서 문제로 지적돼 온 신장 독성 우려를 완화할 가능성을 보여줬다.
에이비엘바이오 관계자는 “이번 논문은 그랩바디-B 기반 전달 플랫폼이 실제로 작동할 수 있음을 확인한 출발점”이라며 “현재는 항체당 siRNA 설계와 접합 기술을 고도화하는 단계로, 초기 데이터 대비 효능이 개선된 결과도 확보하고 있다”고 말했다.
이어 그는 “이번 siRNA 적용 연구는 그랩바디-B가 CNS 단백질 전달 기술을 넘어, 올리고뉴클레오타이드까지 아우를 수 있는 범용 전달 플랫폼으로 확장될 수 있다는 것을 보여줬다”라고 강조했다.
| 인기기사 | 더보기 + |
-
1 메지온 "희귀소아질환 '신속심사바우처'부활,미국 대통령 최종 승인" -
2 베일 벗은 에이비엘바이오 비장의 카드㊤ siRNA와 그랩바디-B -
3 아미코젠, 인도 대리점 Aruni 통해 IEX 레진 첫 상업용 수주 확보 -
4 아미코젠, 신규 인간 히알루로니다제 비임상 효능 확인 -
5 베일 벗은 에이비엘바이오 비장의 카드㊦ siRNA가 ‘꿈의 기술’인 이유 -
6 보로노이,비소세포폐암 환자 'VRN110755' 임상1상 IND 호주 승인 -
7 케어젠,GLP-1 펩타이드 ‘코글루타이드’ FDA NDI 등재 직후 미국 아마존 직행 -
8 "약가 인하, 도매 구조조정 신호탄"…유통 내부서 '단합론' 확산 -
9 무진메디,종근당과 남성형 탈모치료제 'HUTERA' 공동개발계약 체결 -
10 아리바이오, 오스트리아 정부 지원 ‘전자약 GVD-01’ 국제 공동임상시험 착수
| 인터뷰 | 더보기 + |
| PEOPLE | 더보기 + |
| 컬쳐/클래시그널 | 더보기 + |

- 권혁진 기자 hjkwon@yakup.com
- 입력 2026.02.05 08:29 수정 2026.02.05 08:40

에이비엘바이오의 숨겨둔 비장의 카드가 또 한장 공개됐다. 에이비엘바이오는 미국 아이오니스 파마슈티컬스(Ionis Pharmaceuticals)와 IGF1R 표적 항체 기반 BBB(뇌혈관장벽) 셔틀 ‘그랩바디-B(Grabody-B)’를 siRNA 전달에 적용한 공동연구 결과를 최초로 공개했다.
특히 siRNA 단독 정맥투여로는 확인하기 어려웠던 뇌 조직 내 노출과 표적 유전자 억제 신호를 정량 데이터로 제시했다. ‘뇌에 들어갔다’는 결과에 그치지 않고, 중추신경계(Central nervous system, CNS) 부위별 반응 차이와 투여 경로에 따른 효능 변화, 말단 조직에서의 용량과 반응 관계까지 함께 제시했다.
에이비엘바이오는 2일 아이오니스와 공동으로 수행한 연구 결과를 bioRxiv에 선공개했다. 논문 제목은 ‘항-IGF1R 항체 접합을 통한 CNS 및 말초 조직으로의 siRNA 전신·국소 전달(Systemic and Local Delivery of siRNA to the CNS and Periphery via Anti-IGF1R Antibody Conjugation)’이다.
논문에서는 “이번 결과를 통해 그랩바디-B 기반 siRNA 뇌 전달 전략이 실제로 작동할 수 있음을 뒷받침하는 근거가 정량 데이터로 제시됐다”고 밝혔다.
siRNA 오래된 과제…전신 투여와 CNS 전달 한계
siRNA는 특정 유전자 발현을 직접 억제할 수 있는 모달리티로 주목받아 왔지만, 전달(delivery)은 오랫동안 한계로 여겨져 왔다. siRNA는 혈중 안정성과 조직 침투성이 낮아 전신 투여 시 효율적인 표적 도달이 어렵고, 특히 CNS에서는 BBB로 인해 접근성이 제한됐다.
이 때문에 뇌를 직접 표적 하는 다수의 올리고뉴클레오타이드(oligonucleotide) 타입 치료제들은 여전히 뇌척수액 경로를 통한 직접 투여가 이뤄지고 있다. 뇌실내 투여(ICV)나 척수강내 투여(IT)는 BBB를 우회할 수 있다는 장점이 있지만, 반복 시술에 따른 환자 부담과 시술 관련 합병증 위험이라는 한계를 동시에 안고 있다. 또한 이 방식이 뇌 실질 전반에 균일한 분포를 보장하지 못할 수 있다는 점도 임상 현장에서 지속적으로 제기돼 온 문제다.
이 한계를 극복하기 위해 에이비엘바이오와 아이오니스는 IGF1R을 표적하는 항체 기반 BBB 셔틀 그랩바디-B를 활용해 siRNA를 정맥(IV) 및 피하(SC) 투여했을 때, CNS 전달과 유전자 억제가 가능한지를 검증하고자 했다.
그랩바디-B로 확인한 BBB 셔틀 작동 범위
연구진은 IGF1R을 표적하는 BBB 셔틀 항체 ‘그랩바디-B(논문 표기: Clone F)’에 Hprt 표적 siRNA를 접합한 항체-siRNA 복합체 'Clone F-Hprt'를 제작해 실험을 진행했다.
이번 연구에 사용된 siRNA와 접합(conjugation) 구성은 정밀한 최적화를 거친 상업 단계용이 아닌, 전달 플랫폼의 기본 작동 여부를 확인하기 위한 초기 단계 설계였다. 그럼에도 의미 있는 신호가 관찰됐다.
Hprt 표적 siRNA를 단독으로 10 mg/kg 정맥투여했을 때는 뇌 조직에서 유의미한 억제 효과가 나타나지 않았지만, Clone F-Hprt를 정맥투여한 경우 뇌 조직 내 siRNA 노출과 표적 유전자 Hprt 감소가 함께 관찰됐다.
특히 대뇌 피질에서는 siRNA 단독 정맥투여 시 거의 검출되지 않은 반면, Clone F-Hprt 투여 시 용량 의존적인 노출 증가와 함께 약 30% 수준의 유전자 발현 감소가 확인됐다. 이러한 감소 신호는 대뇌뿐 아니라 선조체와 시상 등 심부 뇌 영역에서도 관찰됐다.
데이터는 IGF1R 표적 항체 셔틀 그랩바디-B를 활용한 정맥투여만으로도 CNS 여러 부위에서 표적 유전자 억제가 가능하다는 것을 보여줬다. 또 전신 투여 기반 siRNA의 CNS 접근 가능성을 뒷받침했다.
"정맥투여로 정말 뇌에 들어갔나”…전달 근거 데이터 확보
연구진은 CNS에서 관찰된 유전자 억제 신호가 실제 뇌 조직 전달에 기반한 결과인지 확인하기 위해 siRNA 조직 노출 데이터를 함께 제시했다.
정맥투여 후 대뇌 피질(cortex) 조직에서 siRNA 농도를 정량 분석한 결과, Clone F-Hprt는 0.3 mg/kg 투여 시 약 0.008 µg/g, 10 mg/kg 투여 시 약 0.187 µg/g으로, 용량 증가에 따라 뇌 조직 내 siRNA 노출이 단계적으로 증가하는 양상을 보였다. 반면 Hprt 표적 siRNA를 단독으로 정맥투여한 경우에는 동일 조건에서도 대뇌 조직에서 siRNA 노출이 거의 확인되지 않았다.
이는 siRNA를 뇌실내(ICV)로 직접 투여했을 때의 대뇌 노출 수준(100 µg ICV 투여 시 약 1.388 µg/g)과 비교하면 낮은 수치다. 그러나 정맥투여만으로도 뇌 조직 내 siRNA 농도가 정량적으로 검출됐고, 이에 상응하는 표적 유전자 억제 효과가 함께 관찰됐다는 점은 주목할 만하다.
이번 결과는 에이비엘바이오가 그동안 강조해 온 그랩바디-B의 BBB 셔틀 전략이 단백질 치료제를 넘어, siRNA와 같은 RNA 모달리티로까지 확장될 수 있음을 보여주는 대목이다.

CNS를 넘어 말단 조직까지 ‘전신 전달’
CNS를 넘어 말단 조직에서도 Clone F-Hprt 전달이 정량 데이터로 확인됐다.
정맥투여 10mg/kg 조건에서 Hprt 표적 siRNA를 단독 투여한 경우, 근육(대퇴사두근)에서는 Hprt mRNA 잔존율이 약 53%, 간에서는 약 63% 수준으로 나타났다. 반면 심장, 폐, 신장, 비장 등 다른 말단 조직에서는 유의미한 유전자 억제 효과가 거의 관찰되지 않았다.
Clone F-Hprt를 투여했을 때 결과는 달라졌다. 정맥 및 피하 투여 모두에서 근육, 간, 심장, 폐 등 여러 말단 조직에서 용량 의존적인 유전자 감소 신호가 확인됐다. 정맥투여 10mg/kg 기준으로 근육에서는 mRNA 잔존율이 약 22%, 간 11%, 심장 38%, 폐 62% 수준까지 낮아졌다. 신장과 비장에서는 일관된 Knockdown(유전자 발현 억제) 효과가 확인되지는 않았다.
특히 근육 조직에서는 낮은 용량(0.3 mg/kg)에서도 유전자 억제가 관찰됐다. 조직 내 siRNA 농도에서도 뚜렷한 차이를 보였다. 근육에서 siRNA 단독 정맥투여 시 조직 내 농도는 약 0.19µg/g 수준이었지만, Clone F-Hprt 투여군에서는 약 1.11µg/g으로 약 6배 가까이 높았다.
이 결과는 그랩바디-B 활용은 BBB를 넘는 CNS 전달뿐 아니라, 말단 조직에서 siRNA 노출과 효능까지 함께 끌어올릴 수 있다는 것을 의미한다.
안전성 측면에서도 의미 있는 신호가 관찰됐다. 정맥투여 조건에서 Clone F-Hprt는 siRNA 단독 투여 대비 신장 조직 내 축적이 상대적으로 낮게 나타났다. 해당 데이터만으로 신장 독성 완화를 단정할 수는 없지만, 기존 siRNA 및 소분자 치료제에서 문제로 지적돼 온 신장 독성 우려를 완화할 가능성을 보여줬다.
에이비엘바이오 관계자는 “이번 논문은 그랩바디-B 기반 전달 플랫폼이 실제로 작동할 수 있음을 확인한 출발점”이라며 “현재는 항체당 siRNA 설계와 접합 기술을 고도화하는 단계로, 초기 데이터 대비 효능이 개선된 결과도 확보하고 있다”고 말했다.
이어 그는 “이번 siRNA 적용 연구는 그랩바디-B가 CNS 단백질 전달 기술을 넘어, 올리고뉴클레오타이드까지 아우를 수 있는 범용 전달 플랫폼으로 확장될 수 있다는 것을 보여줬다”라고 강조했다.
무단 전재·복사·배포 등을 금지합니다.



 기자가 쓴 기사 더보기
기자가 쓴 기사 더보기
