ELN 가이드라인서 1차 옵션으로 권고

만성골수성백혈병(CML)은 필라델피아(Ph) 염색체로 인해 생성되는 BCR::ABL1 융합유전자의 비정상적 활성으로 발생하는 만성 골수 증식성 질환이다. 조혈줄기세포의 증식과 분화 조절 기능이 무너지면서 백혈구가 과도하게 증가하고, 치료하지 않을 경우 질환이 가속기 또는 급성기로 진행될 수 있어 초기부터 적극적으로 치료를 시작하는 것이 매우 중요하다.
지난 수십 년간 표준 치료는 ABL 단백질의 ATP 결합부위를 억제하는 티로신키나제억제제(TKI)가 주도해왔다. 하지만 ATP 결합 부위를 표적하는 기존 TKI는 작용 기전의 특성상 선택성이 제한될 수 있어, 일부 환자에서 심혈관계나 간기능 이상 등이 보고된 바 있다. 또한 장기 치료 과정에서 환자에 따라 내성 또는 불내약성, 반응 소실 등으로 치료 조정이 필요한 경우가 있어 실제 임상 현장에서는 다양한 미충족 수요가 남아있었다.
국내 급여 환경
셈블릭스는 2022년 국내에서 두 가지 이상의 TKI 치료에 실패하거나 불내약성을 보이는 만성기 Ph+ CML 성인 환자를 대상으로 최초 허가되었으며(T315I 또는 V299L 변이 제외), 2023년 7월부터 해당 환자군에 대해 건강보험 급여가 적용되기 시작했다.
이후 신규 진단 CML-CP 환자의 1차 치료 적응증까지 허가가 확대됐다.
CML 치료 여정에서 1차 치료의 선택은 이후 치료 경로 전반을 좌우하는 결정적 단계로 평가된다. 진단 직후 충분한 분자반응을 확보하지 못할 경우 치료 변경과 용량 조정이 반복되며 장기 부작용 관리 부담이 커지고, 궁극적으로 치료 목표 달성까지의 기간도 지연될 수 있기 때문이다.
유럽백혈병네트워크(ELN)는 이런 CML 치료의 특성과 셈블릭스의 임상적 가치를 고려하여 2025년 개정된 CML 치료 가이드라인에서 셈블릭스를 신규 진단 환자의 1차 치료의 주요 옵션중 하나로 명시했다. 개정안은 환자의 동반 질환, 내약성, 치료 이력 등을 반영한 개인 맞춤형 초기 치료 전략을 강조하며, 특히 무치료관해(Treatment-Free Remission, TFR)를 달성하기 위한 깊은 분자학적 반응(DMR)의 조기 확보를 핵심 목표로 제시했다.

STAMP 기전, 기존에 없던 ABL 특이 표적 기전
셈블릭스(애시미닙)는 ABL 단백질의 미리스토일 포켓을 표적으로 하는 STAMP(Specifically Targeting the ABL Myristoyl Pocket) 억제제다. 미리스토일 포켓은 ABL 단백질의 자가조절 기능에 관여하는 핵심 부위로, 이를 표적으로 하는 셈블릭스는 ATP 결합 부위를 억제하는 기존 TKI와 작용 기전이 상이하다.
STAMP기전은 ABL에 대한 높은 특이성을 기반으로 하며, 약리학적 분석에서 ABL 외 키나아제에 대한 비특이적 억제가 제한적인 것으로 보고되었다. 이는 장기 치료 환경에서 내약성과 치료 지속성 측면에서 잠재적인 의미를 갖는 기전적 특성으로 언급된다.
초기 치료 단계에서 빠른 반응 유도
ASCEMBL 3상 임상에서 2종 이상의 TKI 치료에 실패하거나 불내약성을 보인 CML 환자 233명을 대상으로 셈블릭스와 보수티닙(2세대 TKI 치료제의 일종)을 비교한 결과, 24주차 주요분자반응(MMR)은 각각 25.5%와 13.2%로 약 2배 차이를 보였으며, 96주차에도 37.6%와 15.8%로 격차가 그대로 유지됐다.
또한 셈블릭스로 MMR을 달성한 환자의 96.7%가 최소 72주 이상 반응을 유지해 장기 반응 지속성이 입증됐고, 96주 시점의 치료 중단율은 7.7%와 26.3%, 치료 유지율은 53.5%와 19.7%로 분석돼 안전성과 치료 지속성 입증했다.
이어 1차 치료에서도 셈블릭스의 효능이 입증되었다. 신규 진단된 Ph+ 만성기 CML 환자 405명을 대상으로 셈블릭스와 이매티닙 또는 2세대 TKI를 1:1로 무작위 배정해 비교한 3상 임상 ASC4FIRST(NCT04971226)가 대표적이다.
이 연구는 MMR을 1차 평가변수로 설정해 두 치료군 간 초기 치료 반응을 직접적으로 비교했다. ASC4FIRST연구에서 셈블릭스는 12주 EMR(초기 반응), 48주 및 96주 MMR·MR4(심층반응) 모두에서 더 빠르고 깊은 분자학적 반응을 보였다.

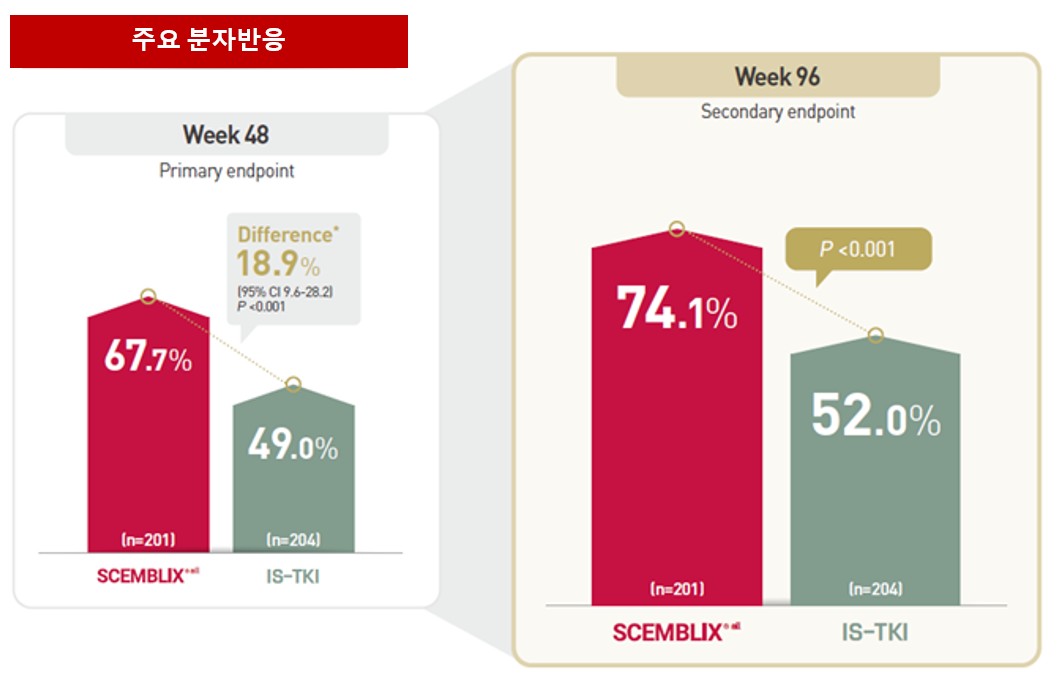
셈블릭스의 조기분자반응(EMR)은 89.6%였다. 48주 MMR은 셈블릭스 67.7%로 나타났다. 또한 장기 추적(96주)에서도 결과는 일관적으로 유지되는 경향을 보였다. 96주 MMR은 셈블릭스 74.1%로 치료 기간이 경과해도 높은 주요분자반응 도달률을 확인했다.
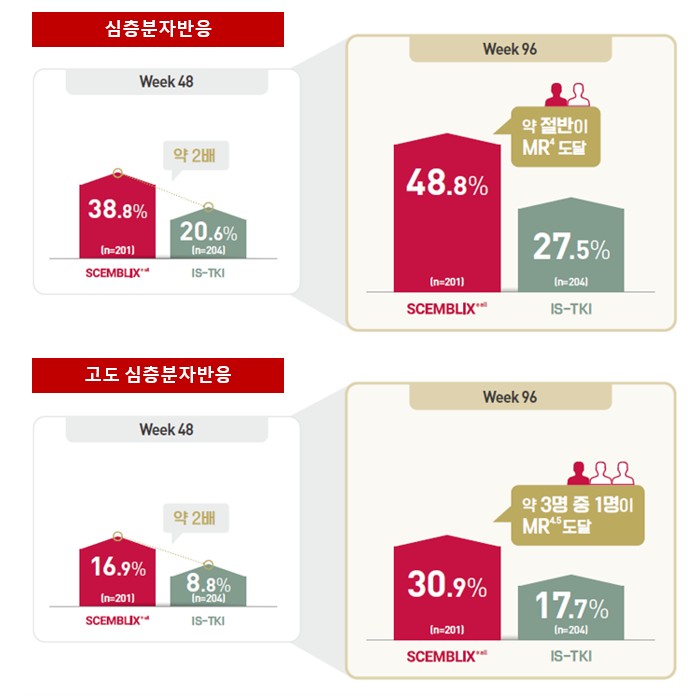
같은 연구에서 셈블릭스의 48주 심층분자반응(MR4)은 38.8%로 비교군 20.6% 대비 높게 나타났다.9 또한 ELTS(위험도 평가 기준)에 따른 위험도, 연령, 성별 등 주요 하위군 분석에서도 셈블릭스의 48주 MMR은 표준 TKI 대비 더 높은 수치를 기록해, 환자 특성에 관계없이 일관된 반응 경향이 나타났다.9 96주차 결과에서도 격차는 유지되었다.10 심층분자반응(MR4)의 경우 셈블릭스 96주 차에 48.8%, 표준 TKI 27.5%였으며, 고도 심층분자반응(MR4.5)은 셈블릭스 30.9%, 표준 TKI 17.7%로 장기 시점에서 더 깊은 반응에 도달한 환자 비율이 더 높게 나타났다.10
치료 핵심 ‘지속성’…내약성·안전성 모두 안정적
ASC4FIRST의 안전성 분석에서 셈블릭스는 치료 지속성과 내약성 측면에서 안정적인 모습을 보였다. 연구의 중간 추적 기간은 셈블릭스 16.3개월, 표준 TKI 15.7개월로 비슷했지만, 치료를 유지한 환자 비율은 각각 86.1%와 68.6%로 차이가 나타났다. 전체 치료 중단률은 셈블릭스 13.4%, 표준 TKI 29.9%였으며, 주요 중단 사유에서도 일관된 차이가 확인됐다. 효과 불충분은 6.0% 대 15.2%, ELN 기준 치료 실패는 5.0% 대 11.8%, 이상반응으로 인한 중단은 5.5% 대 10.3%로 각각 나타났다.
중등도 이상(Grade 3) 이상반응 발생률은 셈블릭스 38.0%, 이매티닙 44.4%, 2세대 TKI 54.9%로 단계적으로 증가하는 양상을 보였다. 용량 조정 또는 일시 중단이 필요한 이상반응도 셈블릭스 30.0%, 이미티닙 39.4%, 2세대 TKI 52.9%로 확인돼, 내약성 측면에서도 차이가 나타났다.
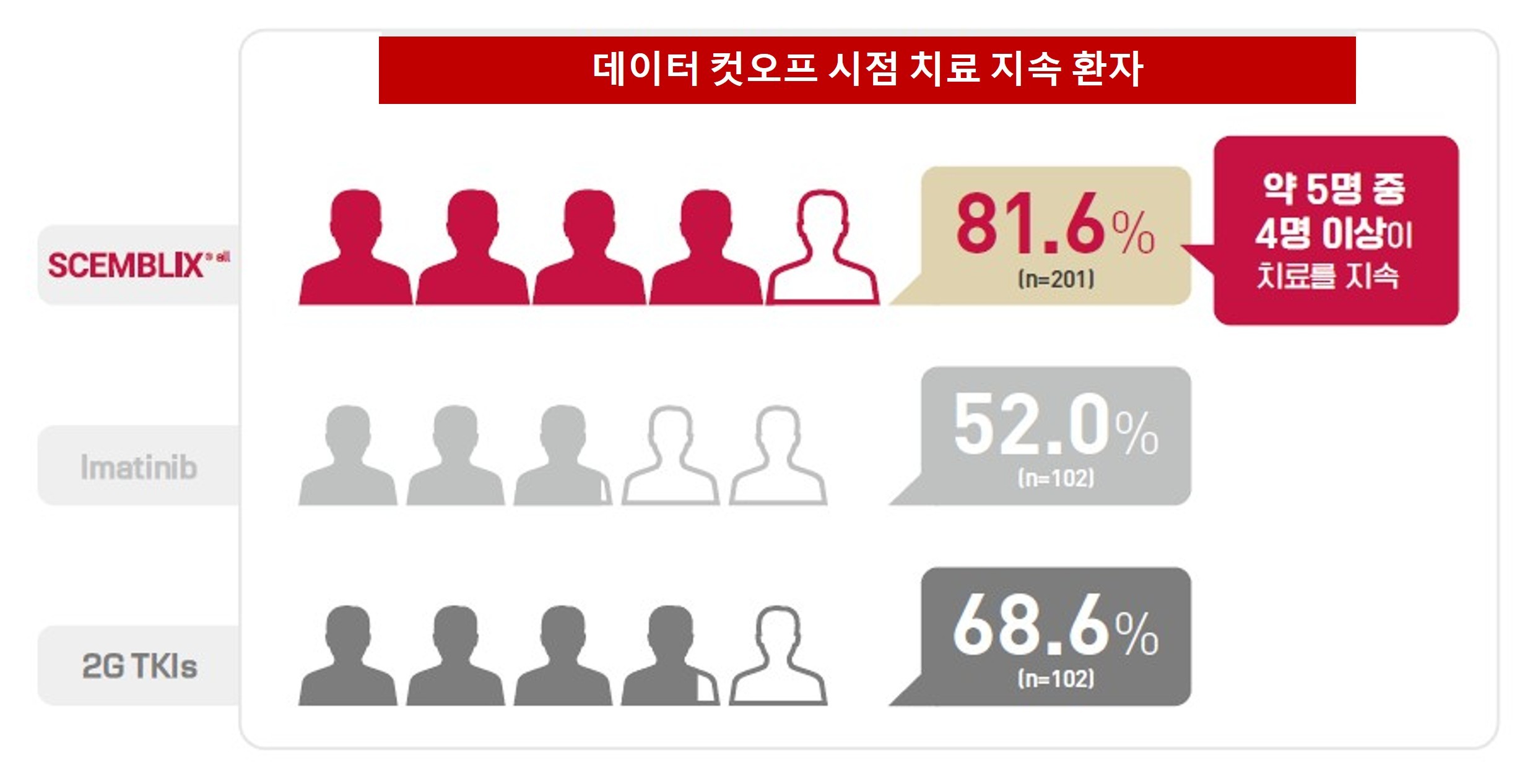
이러한 치료 지속성과 내약성의 차이는 2차 중앙 추적 기간(2.2년)에도 동일한 방향으로 유지됐다. 컷오프 시점(2024년 10월 22일) 기준으로 치료를 지속 중인 환자 비율은 셈블릭스 군에서 81.6%로, 이매티닙(52.0%)과 2세대 TKI(68.6%) 대비 높게 나타났다.
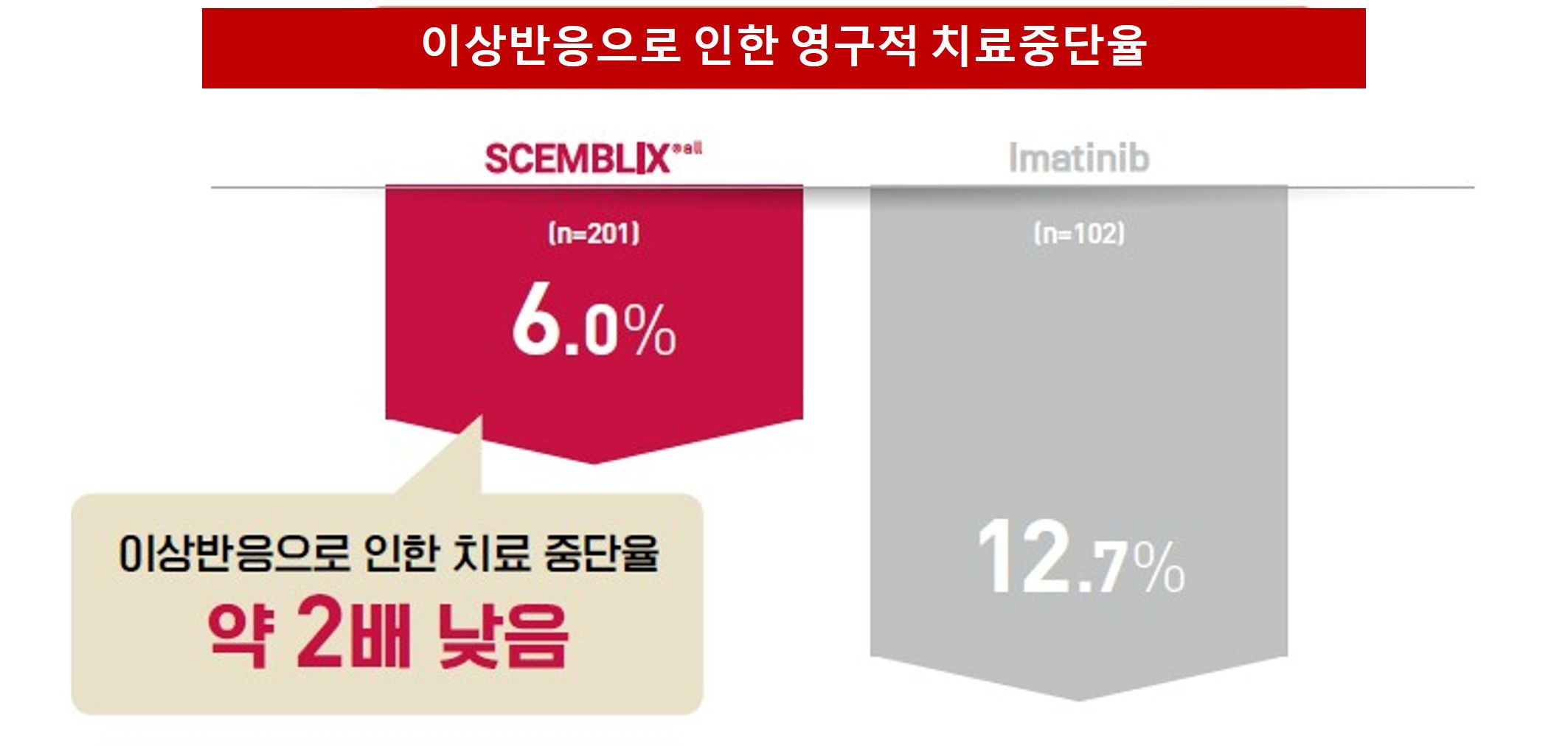
또한 이상반응으로 인한 영구적 치료 중단 비율은 셈블릭스 6.0%, 이매티닙 12.7%로 확인돼, 장기 치료 환경에서도 내약성 기반의 치료 유지에 유리한 프로파일을 재확인했다.

- 최윤수 기자 jjysc0229@yakup.com
- 입력 2026.02.09 06:00 수정 2026.02.09 06:01

만성골수성백혈병(CML)은 필라델피아(Ph) 염색체로 인해 생성되는 BCR::ABL1 융합유전자의 비정상적 활성으로 발생하는 만성 골수 증식성 질환이다. 조혈줄기세포의 증식과 분화 조절 기능이 무너지면서 백혈구가 과도하게 증가하고, 치료하지 않을 경우 질환이 가속기 또는 급성기로 진행될 수 있어 초기부터 적극적으로 치료를 시작하는 것이 매우 중요하다.
지난 수십 년간 표준 치료는 ABL 단백질의 ATP 결합부위를 억제하는 티로신키나제억제제(TKI)가 주도해왔다. 하지만 ATP 결합 부위를 표적하는 기존 TKI는 작용 기전의 특성상 선택성이 제한될 수 있어, 일부 환자에서 심혈관계나 간기능 이상 등이 보고된 바 있다. 또한 장기 치료 과정에서 환자에 따라 내성 또는 불내약성, 반응 소실 등으로 치료 조정이 필요한 경우가 있어 실제 임상 현장에서는 다양한 미충족 수요가 남아있었다.
국내 급여 환경
셈블릭스는 2022년 국내에서 두 가지 이상의 TKI 치료에 실패하거나 불내약성을 보이는 만성기 Ph+ CML 성인 환자를 대상으로 최초 허가되었으며(T315I 또는 V299L 변이 제외), 2023년 7월부터 해당 환자군에 대해 건강보험 급여가 적용되기 시작했다.
이후 신규 진단 CML-CP 환자의 1차 치료 적응증까지 허가가 확대됐다.
CML 치료 여정에서 1차 치료의 선택은 이후 치료 경로 전반을 좌우하는 결정적 단계로 평가된다. 진단 직후 충분한 분자반응을 확보하지 못할 경우 치료 변경과 용량 조정이 반복되며 장기 부작용 관리 부담이 커지고, 궁극적으로 치료 목표 달성까지의 기간도 지연될 수 있기 때문이다.
유럽백혈병네트워크(ELN)는 이런 CML 치료의 특성과 셈블릭스의 임상적 가치를 고려하여 2025년 개정된 CML 치료 가이드라인에서 셈블릭스를 신규 진단 환자의 1차 치료의 주요 옵션중 하나로 명시했다. 개정안은 환자의 동반 질환, 내약성, 치료 이력 등을 반영한 개인 맞춤형 초기 치료 전략을 강조하며, 특히 무치료관해(Treatment-Free Remission, TFR)를 달성하기 위한 깊은 분자학적 반응(DMR)의 조기 확보를 핵심 목표로 제시했다.

STAMP 기전, 기존에 없던 ABL 특이 표적 기전
셈블릭스(애시미닙)는 ABL 단백질의 미리스토일 포켓을 표적으로 하는 STAMP(Specifically Targeting the ABL Myristoyl Pocket) 억제제다. 미리스토일 포켓은 ABL 단백질의 자가조절 기능에 관여하는 핵심 부위로, 이를 표적으로 하는 셈블릭스는 ATP 결합 부위를 억제하는 기존 TKI와 작용 기전이 상이하다.
STAMP기전은 ABL에 대한 높은 특이성을 기반으로 하며, 약리학적 분석에서 ABL 외 키나아제에 대한 비특이적 억제가 제한적인 것으로 보고되었다. 이는 장기 치료 환경에서 내약성과 치료 지속성 측면에서 잠재적인 의미를 갖는 기전적 특성으로 언급된다.
초기 치료 단계에서 빠른 반응 유도
ASCEMBL 3상 임상에서 2종 이상의 TKI 치료에 실패하거나 불내약성을 보인 CML 환자 233명을 대상으로 셈블릭스와 보수티닙(2세대 TKI 치료제의 일종)을 비교한 결과, 24주차 주요분자반응(MMR)은 각각 25.5%와 13.2%로 약 2배 차이를 보였으며, 96주차에도 37.6%와 15.8%로 격차가 그대로 유지됐다.
또한 셈블릭스로 MMR을 달성한 환자의 96.7%가 최소 72주 이상 반응을 유지해 장기 반응 지속성이 입증됐고, 96주 시점의 치료 중단율은 7.7%와 26.3%, 치료 유지율은 53.5%와 19.7%로 분석돼 안전성과 치료 지속성 입증했다.
이어 1차 치료에서도 셈블릭스의 효능이 입증되었다. 신규 진단된 Ph+ 만성기 CML 환자 405명을 대상으로 셈블릭스와 이매티닙 또는 2세대 TKI를 1:1로 무작위 배정해 비교한 3상 임상 ASC4FIRST(NCT04971226)가 대표적이다.
이 연구는 MMR을 1차 평가변수로 설정해 두 치료군 간 초기 치료 반응을 직접적으로 비교했다. ASC4FIRST연구에서 셈블릭스는 12주 EMR(초기 반응), 48주 및 96주 MMR·MR4(심층반응) 모두에서 더 빠르고 깊은 분자학적 반응을 보였다.


셈블릭스의 조기분자반응(EMR)은 89.6%였다. 48주 MMR은 셈블릭스 67.7%로 나타났다. 또한 장기 추적(96주)에서도 결과는 일관적으로 유지되는 경향을 보였다. 96주 MMR은 셈블릭스 74.1%로 치료 기간이 경과해도 높은 주요분자반응 도달률을 확인했다.

같은 연구에서 셈블릭스의 48주 심층분자반응(MR4)은 38.8%로 비교군 20.6% 대비 높게 나타났다.9 또한 ELTS(위험도 평가 기준)에 따른 위험도, 연령, 성별 등 주요 하위군 분석에서도 셈블릭스의 48주 MMR은 표준 TKI 대비 더 높은 수치를 기록해, 환자 특성에 관계없이 일관된 반응 경향이 나타났다.9 96주차 결과에서도 격차는 유지되었다.10 심층분자반응(MR4)의 경우 셈블릭스 96주 차에 48.8%, 표준 TKI 27.5%였으며, 고도 심층분자반응(MR4.5)은 셈블릭스 30.9%, 표준 TKI 17.7%로 장기 시점에서 더 깊은 반응에 도달한 환자 비율이 더 높게 나타났다.10
치료 핵심 ‘지속성’…내약성·안전성 모두 안정적
ASC4FIRST의 안전성 분석에서 셈블릭스는 치료 지속성과 내약성 측면에서 안정적인 모습을 보였다. 연구의 중간 추적 기간은 셈블릭스 16.3개월, 표준 TKI 15.7개월로 비슷했지만, 치료를 유지한 환자 비율은 각각 86.1%와 68.6%로 차이가 나타났다. 전체 치료 중단률은 셈블릭스 13.4%, 표준 TKI 29.9%였으며, 주요 중단 사유에서도 일관된 차이가 확인됐다. 효과 불충분은 6.0% 대 15.2%, ELN 기준 치료 실패는 5.0% 대 11.8%, 이상반응으로 인한 중단은 5.5% 대 10.3%로 각각 나타났다.
중등도 이상(Grade 3) 이상반응 발생률은 셈블릭스 38.0%, 이매티닙 44.4%, 2세대 TKI 54.9%로 단계적으로 증가하는 양상을 보였다. 용량 조정 또는 일시 중단이 필요한 이상반응도 셈블릭스 30.0%, 이미티닙 39.4%, 2세대 TKI 52.9%로 확인돼, 내약성 측면에서도 차이가 나타났다.


이러한 치료 지속성과 내약성의 차이는 2차 중앙 추적 기간(2.2년)에도 동일한 방향으로 유지됐다. 컷오프 시점(2024년 10월 22일) 기준으로 치료를 지속 중인 환자 비율은 셈블릭스 군에서 81.6%로, 이매티닙(52.0%)과 2세대 TKI(68.6%) 대비 높게 나타났다.
또한 이상반응으로 인한 영구적 치료 중단 비율은 셈블릭스 6.0%, 이매티닙 12.7%로 확인돼, 장기 치료 환경에서도 내약성 기반의 치료 유지에 유리한 프로파일을 재확인했다.
무단 전재·복사·배포 등을 금지합니다.



 기자가 쓴 기사 더보기
기자가 쓴 기사 더보기
