국내 기업 IND 승인 전혀 없어
식품의약품안전처가 지난달 승인한 IND(임상시험계획승인신청) 중 대부분이 항암제 개발 임상시험에 집중됐다. 국내 기업 중에서는 IND를 승인받은 곳이 단 한 곳도 없었다.
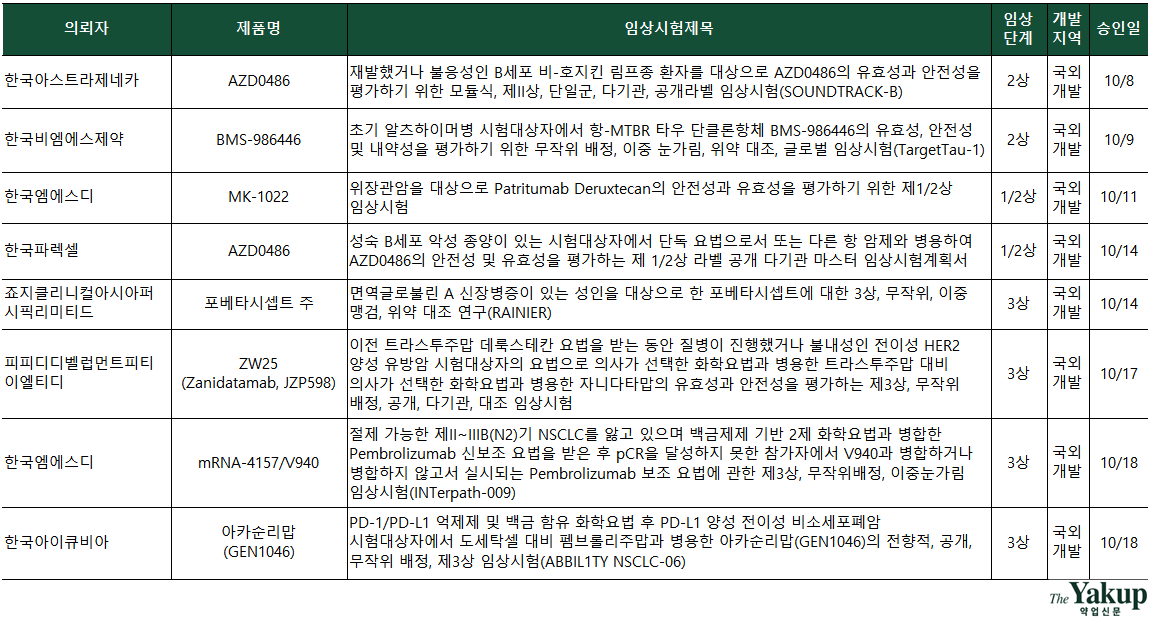
약업닷컴(약업신문)이 12일 한국바이오의약품협회의 산업동향정보와 식약처 의약품통합정보시스템 자료를 분석한 결과, 지난 10월 한 달간(1일~31일) 바이오의약품 IND는 총 16건이 승인됐다. 전체 승인된 IND 중 임상 3상이 8건으로 가장 많았고, 1상(1/2상)과 2상(2/3상)은 각각 4건으로 같은 수를 기록했다.
3상을 승인받은 기업은 △죠지클리니컬아시아퍼시픽(CRO) △피피디디벨럽먼트피티이엘티디(CRO) △한국엠에스디(미국 머크, 이하 MSD) △한국아이큐비아(CRO) △메드페이스(CRO) △한국얀센 △아이콘클리니컬리서치코리아(CRO)다. 이 중 피피디디벨럽먼트피티이엘티디는 3상 IND를 2건 승인받았다.
이번 달에는 항암제 개발 IND 승인이 대다수를 차지했다는 점이 눈에 띈다. 전체 16건 중 10건이 항종양 타깃 임상시험으로 나타났다. 더욱이 개발이 어렵다고 여겨지는 고형암을 대상으로 한 임상시험이 더 많은 비중을 차지했다. 고형암 타깃 임상시험은 6건, 혈액암 타깃 임상시험은 4건이다.
MSD는 다이이찌산쿄와 공동 개발 중인 HER3 표적 ADC(항체약물접합체) 신약 후보 'MK-1022(Patritumab Deruxtecan)'의 국내 임상을 본격화한다. 이번에 승인받은 IND는 위장관암 환자를 대상으로 한 임상 1/2상이다.
MK-1022는 MSD가 지난달 유럽종양학회(ESMO)에서 긍정적인 임상 3상 결과를 발표하며 학계와 업계의 주목을 받았다. MSD는 비소세포폐암을 대상으로 한 임상 3상에서 주요 평가지표인 무진행생존기간(PFS)을 충족하며 통계적으로 유의미한 결과를 얻었다고 밝혔다. 현재 MK-1022는 FDA 심사가 진행 중이며, 출시를 앞둔 신약으로 높은 기대를 모으고 있다.
HER3는 HER2와 유사하게 종양 세포에서 과발현되는 경우가 많아 암의 발생과 전이, 치료 저항성을 높이는 요인으로 작용한다. HER3는 주로 대장암, 유방암, 폐암 등 다양한 암에서 과발현된다. HER3는 HER2와는 달리 특정 암종에 특이적으로 발현되지 않고, 여러 암종에서 폭넓게 관여하는 특징을 가진다. 기존 치료제에 반응하지 않거나 저항성을 보이는 암에 대해 효과를 기대할 수 있다.
MK-1022는 현재 △상피세포 성장인자 수용체(EGFR) 변이 비소세포폐암(NSCLC) 외에도 △호르몬 수용체 양성(HR+) 및 인간 상피세포 성장인자 수용체2(HER2) 음성 진행성 유방암 △진행성 위장관암 등을 대상으로 임상 2상이 진행되고 있다.
또한 MSD는 모더나와 공동으로 개발 중인 mRNA 기반 암 백신 'mRNA-4157(V940)'의 국내 임상 3상도 본격화한다. MSD는 mRNA-4157을 키트루다와 병용해 치료 효과를 평가할 예정이다.
mRNA-4157은 환자의 종양에서 발견되는 고유한 돌연변이 서열을 기반으로 최대 34개의 네오안티젠을 암호화하는 합성 mRNA로 구성돼 있다. 이 mRNA는 환자의 종양에만 존재하는 돌연변이 항원을 암호화해, 면역 시스템이 이러한 항원을 인식하고 특정적으로 공격할 수 있도록 유도한다. 특히 키트루다와 병용할 경우 면역 반응을 더욱 강화시켜 암세포를 효과적으로 제거할 것으로 평가된다.
이 외에도 10월에 승인된 IND 중 고형암을 대상으로 한 임상시험으로는 △피피디디벨럽먼트피티이엘티디가 유방암을 타깃으로 한 'ZW25 (Zanidatamab, JZP598)' 임상 3상, △한국아이큐비아가 비소세포폐암을 타깃으로 한 아카순리맙(GEN1046) 임상 3상, △시네오스헬스코리아가 난소암과 비소세포폐암을 타깃으로 한 'ZW171' 임상 1상, △한국얀센이 직결장암을 타깃으로 한 'JNJ-61186372' 임상 3상을 각각 승인받았다.

| 인기기사 | 더보기 + |
-
1 케어젠 ‘CG-P5’,국제망막학회 초록 동시채택..글로벌 2상-FDA BTD 추진 가속 -
2 산딸기, 혈당 조절ㆍ인지력 개선..딸기가 좋아~ -
3 샌프란 거리를 누빈 10년의 단상…오름테라퓨틱 이승주 대표 JPMHC 실전 공략 -
4 한미약품그룹, 2137억 '빅딜'로 분쟁 종식… '전문경영인 패싱' 논란 딛고 R&D·내부결속 속도 -
5 비보존제약, 유증 103% 청약…경영진 참여 속 완판 -
6 인트론바이오,스위스 ‘AMR 컨퍼런스’서 SAL200 ‘완전 멸균’ 효능 데이터 발표 -
7 한국유니온제약, 자본전액잠식…부광 인수 진행 속 상장 유지 시험대 -
8 글로벌 제약사의 쓰라린 패배…2025 실패 임상 TOP 10 ① -
9 '실적 한파' 중소 제약사...양극화 심화 -
10 삼천당제약,당뇨약 '리벨서스'-경구 '위고비' 제네릭 11개국 라이선스 계약
| 인터뷰 | 더보기 + |
| PEOPLE | 더보기 + |
| 컬쳐/클래시그널 | 더보기 + |

국내 기업 IND 승인 전혀 없어
- 권혁진 기자 hjkwon@yakup.com
- 입력 2024.11.13 06:00 수정 2024.11.13 06:01

식품의약품안전처가 지난달 승인한 IND(임상시험계획승인신청) 중 대부분이 항암제 개발 임상시험에 집중됐다. 국내 기업 중에서는 IND를 승인받은 곳이 단 한 곳도 없었다.
약업닷컴(약업신문)이 12일 한국바이오의약품협회의 산업동향정보와 식약처 의약품통합정보시스템 자료를 분석한 결과, 지난 10월 한 달간(1일~31일) 바이오의약품 IND는 총 16건이 승인됐다. 전체 승인된 IND 중 임상 3상이 8건으로 가장 많았고, 1상(1/2상)과 2상(2/3상)은 각각 4건으로 같은 수를 기록했다.
3상을 승인받은 기업은 △죠지클리니컬아시아퍼시픽(CRO) △피피디디벨럽먼트피티이엘티디(CRO) △한국엠에스디(미국 머크, 이하 MSD) △한국아이큐비아(CRO) △메드페이스(CRO) △한국얀센 △아이콘클리니컬리서치코리아(CRO)다. 이 중 피피디디벨럽먼트피티이엘티디는 3상 IND를 2건 승인받았다.
이번 달에는 항암제 개발 IND 승인이 대다수를 차지했다는 점이 눈에 띈다. 전체 16건 중 10건이 항종양 타깃 임상시험으로 나타났다. 더욱이 개발이 어렵다고 여겨지는 고형암을 대상으로 한 임상시험이 더 많은 비중을 차지했다. 고형암 타깃 임상시험은 6건, 혈액암 타깃 임상시험은 4건이다.

MSD는 다이이찌산쿄와 공동 개발 중인 HER3 표적 ADC(항체약물접합체) 신약 후보 'MK-1022(Patritumab Deruxtecan)'의 국내 임상을 본격화한다. 이번에 승인받은 IND는 위장관암 환자를 대상으로 한 임상 1/2상이다.
MK-1022는 MSD가 지난달 유럽종양학회(ESMO)에서 긍정적인 임상 3상 결과를 발표하며 학계와 업계의 주목을 받았다. MSD는 비소세포폐암을 대상으로 한 임상 3상에서 주요 평가지표인 무진행생존기간(PFS)을 충족하며 통계적으로 유의미한 결과를 얻었다고 밝혔다. 현재 MK-1022는 FDA 심사가 진행 중이며, 출시를 앞둔 신약으로 높은 기대를 모으고 있다.
HER3는 HER2와 유사하게 종양 세포에서 과발현되는 경우가 많아 암의 발생과 전이, 치료 저항성을 높이는 요인으로 작용한다. HER3는 주로 대장암, 유방암, 폐암 등 다양한 암에서 과발현된다. HER3는 HER2와는 달리 특정 암종에 특이적으로 발현되지 않고, 여러 암종에서 폭넓게 관여하는 특징을 가진다. 기존 치료제에 반응하지 않거나 저항성을 보이는 암에 대해 효과를 기대할 수 있다.
MK-1022는 현재 △상피세포 성장인자 수용체(EGFR) 변이 비소세포폐암(NSCLC) 외에도 △호르몬 수용체 양성(HR+) 및 인간 상피세포 성장인자 수용체2(HER2) 음성 진행성 유방암 △진행성 위장관암 등을 대상으로 임상 2상이 진행되고 있다.
또한 MSD는 모더나와 공동으로 개발 중인 mRNA 기반 암 백신 'mRNA-4157(V940)'의 국내 임상 3상도 본격화한다. MSD는 mRNA-4157을 키트루다와 병용해 치료 효과를 평가할 예정이다.
mRNA-4157은 환자의 종양에서 발견되는 고유한 돌연변이 서열을 기반으로 최대 34개의 네오안티젠을 암호화하는 합성 mRNA로 구성돼 있다. 이 mRNA는 환자의 종양에만 존재하는 돌연변이 항원을 암호화해, 면역 시스템이 이러한 항원을 인식하고 특정적으로 공격할 수 있도록 유도한다. 특히 키트루다와 병용할 경우 면역 반응을 더욱 강화시켜 암세포를 효과적으로 제거할 것으로 평가된다.
이 외에도 10월에 승인된 IND 중 고형암을 대상으로 한 임상시험으로는 △피피디디벨럽먼트피티이엘티디가 유방암을 타깃으로 한 'ZW25 (Zanidatamab, JZP598)' 임상 3상, △한국아이큐비아가 비소세포폐암을 타깃으로 한 아카순리맙(GEN1046) 임상 3상, △시네오스헬스코리아가 난소암과 비소세포폐암을 타깃으로 한 'ZW171' 임상 1상, △한국얀센이 직결장암을 타깃으로 한 'JNJ-61186372' 임상 3상을 각각 승인받았다.

무단 전재·복사·배포 등을 금지합니다.



 기자가 쓴 기사 더보기
기자가 쓴 기사 더보기
