 기자가 쓴 기사 더보기
기자가 쓴 기사 더보기
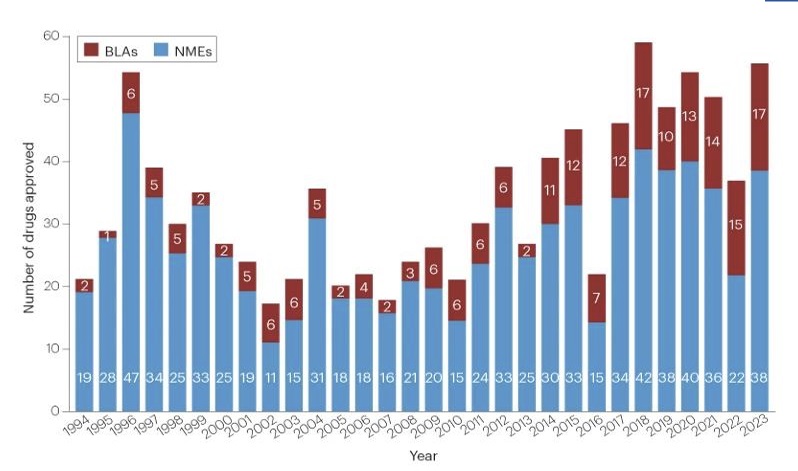
미국 식품의약국(FDA)이 의약품 평가연구센터 기준 지난해 총 55개의 신약을 승인한 것으로 확인됐다. 적응증 유형별로는 암 치료제(oncology)가 13건으로 가장 많았다.
국가신약개발사업단은 ‘지난해 FDA 신약 승인 현황’을 분석해 이같이 밝혔다.
사업단에 따르면 지난해 FDA는 의약품 평가연구센터(CDER)에서 55개, 생물의약품 평가연구센터(CBER)에서 16개 등 총 71개의 신약을 승인했다. 전년인 2022년의 승인 건수가 총 45건인 점을 감안하면 지난해 승인 건수는 크게 증가했다. 특히 CDER 기준으로는 약 50% 증가한 것으로 나타났다.
승인 내역을 적응증 유형별로 살펴보면, 암 치료제가 24%인 13건 승인돼 가장 큰 비중을 차지했다. 이어 신경질환(Neurology)이 9건, 감염성 질환(Infectious diseases)과 혈액 질환(Haematology)가 각각 5건씩 승인받았다.
모달리티 유형별로는 저분자 신약(Small molecules)이 총 34건으로 62%를 차지해 가장 많았다. 이어 단일항체 8건과 이중항체 4건 등을 포함한 단백질 신약(Proteins)은 총 17건 승인됐다. RNA 압타머 제품 승인(1건)을 포함한 올리고뉴클레오타이드(Oligonucleotides) 치료제 승인은 총 4건이었다.
반면 지난해 FDA가 승인을 거절한 약물은 △도나네맙(일라이릴리) △오메캄티브 메카빌(사이토키네틱스) △인바키셉트(이뮤니티바이오) △콘시주맙(노보 노디스크) △오베티콜릭산(알파시그마) △아바소파젬 망간(갈레라) △레브리키주맙(일라이릴리) △게파픽산트(머크) 등이 있다. 주라놀론(세이지)은 기존에 신청한 주요 우울장애로는 거절됐으나 산후우울증 치료제로 지난해 8월 승인받았다.
네이쳐리뷰지가 소개한 올해 주목할 만한 파이프라인은 19개다. △졸베툭시맙(Zolbetuximab) △리필류셀(Lifileucel) △레스메티롬(Resmetirom) △소타터셉트(Sotatercept) △mRNA-1345 △도나네맙(Donanemab) △EB-101 △파트리투맙 데룩스테칸(Patritumab deruxtecan) △이메텔스탯(Imetelstat) △탈라타맙(Tarlatamab) △피다나코진 엘라파보벡(Fidanacogene elaparvovec) △벤트라시맙(Bentracimab) △크로발리맙(Crovalimab) △다니코판(Danicopan) △미도마페타민(Midomafetamine) △KarXT △아코라미디스(Acoramidis) △마스타시맙(Marstacimab) △아파미셀(Afami-cel) 등이다.
| 인기기사 | 더보기 + |
-
1 ‘46조 원’ 대박 예고…2026 최고 기대 신약 TOP 10 ① -
2 경구 비만 치료제 임상 2상..체중 최대 12.1% ↓ -
3 ‘46조 원’ 대박 예고…2026 최고 기대 신약 TOP 10 ② -
4 ‘매출 1조원 신화’ 오상훈 대표, 오가노이드사이언스 첫 공식 행보 -
5 네이처셀,노벨 생리의학상 수상자 그랙 세멘자 교수 기술자문계약 -
6 툴젠, 소송·협상 전문가 구본천 최고법률책임자 영입 -
7 [2월 1주] 한미 '어닝 서프라이즈'·명인 'R&D 올인'… 제약바이오, 실적·투자로 포문 -
8 에이프로젠 자회사 앱튼, 150억원 규모 3자배정 유상증자 발행 철회 -
9 미국, ‘생물보안법’ 통한 바이오 이어 중국 임상시험도 견제 -
10 유유제약, '고양이 바이오 신약'으로 승부수 띄웠다
| 인터뷰 | 더보기 + |
| PEOPLE | 더보기 + |
| 컬쳐/클래시그널 | 더보기 + |

- 이주영 기자 jylee@yakup.com
- 입력 2024.01.17 06:06 수정 2024.01.18 16:31

미국 식품의약국(FDA)이 의약품 평가연구센터 기준 지난해 총 55개의 신약을 승인한 것으로 확인됐다. 적응증 유형별로는 암 치료제(oncology)가 13건으로 가장 많았다.
국가신약개발사업단은 ‘지난해 FDA 신약 승인 현황’을 분석해 이같이 밝혔다.
사업단에 따르면 지난해 FDA는 의약품 평가연구센터(CDER)에서 55개, 생물의약품 평가연구센터(CBER)에서 16개 등 총 71개의 신약을 승인했다. 전년인 2022년의 승인 건수가 총 45건인 점을 감안하면 지난해 승인 건수는 크게 증가했다. 특히 CDER 기준으로는 약 50% 증가한 것으로 나타났다.
승인 내역을 적응증 유형별로 살펴보면, 암 치료제가 24%인 13건 승인돼 가장 큰 비중을 차지했다. 이어 신경질환(Neurology)이 9건, 감염성 질환(Infectious diseases)과 혈액 질환(Haematology)가 각각 5건씩 승인받았다.
모달리티 유형별로는 저분자 신약(Small molecules)이 총 34건으로 62%를 차지해 가장 많았다. 이어 단일항체 8건과 이중항체 4건 등을 포함한 단백질 신약(Proteins)은 총 17건 승인됐다. RNA 압타머 제품 승인(1건)을 포함한 올리고뉴클레오타이드(Oligonucleotides) 치료제 승인은 총 4건이었다.
반면 지난해 FDA가 승인을 거절한 약물은 △도나네맙(일라이릴리) △오메캄티브 메카빌(사이토키네틱스) △인바키셉트(이뮤니티바이오) △콘시주맙(노보 노디스크) △오베티콜릭산(알파시그마) △아바소파젬 망간(갈레라) △레브리키주맙(일라이릴리) △게파픽산트(머크) 등이 있다. 주라놀론(세이지)은 기존에 신청한 주요 우울장애로는 거절됐으나 산후우울증 치료제로 지난해 8월 승인받았다.
네이쳐리뷰지가 소개한 올해 주목할 만한 파이프라인은 19개다. △졸베툭시맙(Zolbetuximab) △리필류셀(Lifileucel) △레스메티롬(Resmetirom) △소타터셉트(Sotatercept) △mRNA-1345 △도나네맙(Donanemab) △EB-101 △파트리투맙 데룩스테칸(Patritumab deruxtecan) △이메텔스탯(Imetelstat) △탈라타맙(Tarlatamab) △피다나코진 엘라파보벡(Fidanacogene elaparvovec) △벤트라시맙(Bentracimab) △크로발리맙(Crovalimab) △다니코판(Danicopan) △미도마페타민(Midomafetamine) △KarXT △아코라미디스(Acoramidis) △마스타시맙(Marstacimab) △아파미셀(Afami-cel) 등이다.
무단 전재·복사·배포 등을 금지합니다.



