美 '첨단재생의료치료제' IND 200%↑…최종 '단 6품목' 허가
전체 IND 신청 16년 223건→20년 666건·유전자치료제 67→160·세포치료제 63→151
입력 2021.10.18 06:00
수정 2022.01.07 22:20
전 세계적으로 첨단재생의료치료제 개발이 활발히 이뤄지고 있다. 미국 FDA의 OTAT에 신청된 전체 IND 건수가 2020년 기준 666건으로 최대치를 나타냈으며, 올해 이를 돌파할 것이라고 예측되고 있다. 그러나 현재까지 최종 허가받은 품목은 6건에 불과해 허가전략을 재설정할 필요가 있다는 의견이 제시됐다.

주보스턴대한민국총영사관과 한국보건산업진흥원 미국지사가 한미 첨단재생의료 협력 확대를 위한 `첨단재생의료 포럼`을 한국 시간 15일(미국 현지 시간 14일)에 개최했다.
이날 포럼에는 ▲BW BioMed 우정훈 대표 ▲재생의료진흥재단 박소라 이사장 ▲FDA 재생의료 심사역 성경은 박사 ▲Biogen Gene Therapy 그룹장 서혜경 박사 ▲Decibel Therapeutics Senior Scientist 정유진 박사가 참석해 글로벌 첨단재생의료 산업과 한국의 첨단재생의료 산업 발전을 주제로 논의하는 시간을 가졌다.
성경은 박사는 `Regulatory science and CMC considerations for regenerative medicine cellular products`라는 주제로 미국 FDA에서 첨단재생의료치료제에 관한 최신 동향을 소개했다.
성경은 박사는 “유전자치료제와 세포치료제 등 첨단재생의료치료제가 전 세계적으로 많은 관심을 받고 있으며, 이전에는 치료가 불가능했던 희귀질환 치료에 대한 기대로 다양한 신약개발을 위한 움직임이 활발하다”고 산업 동향을 전했다.
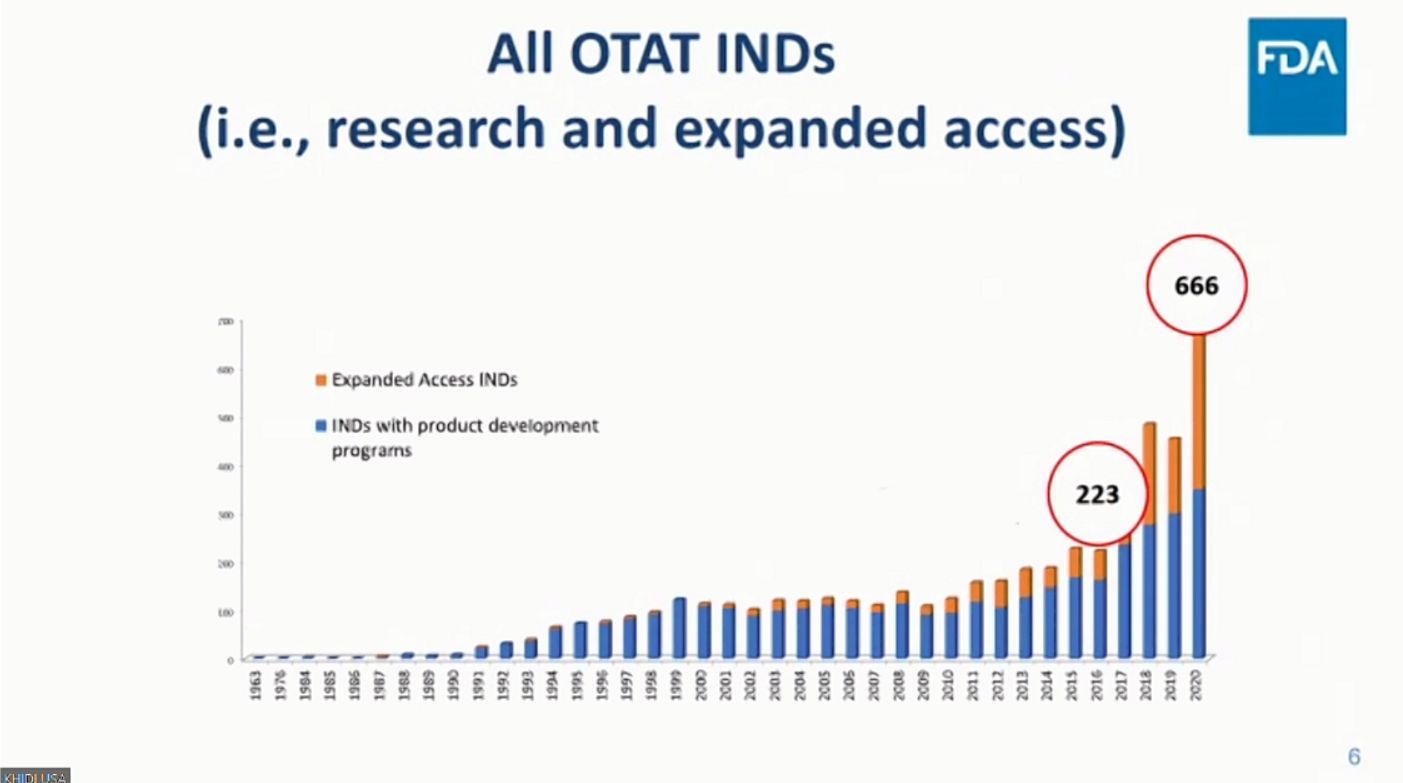
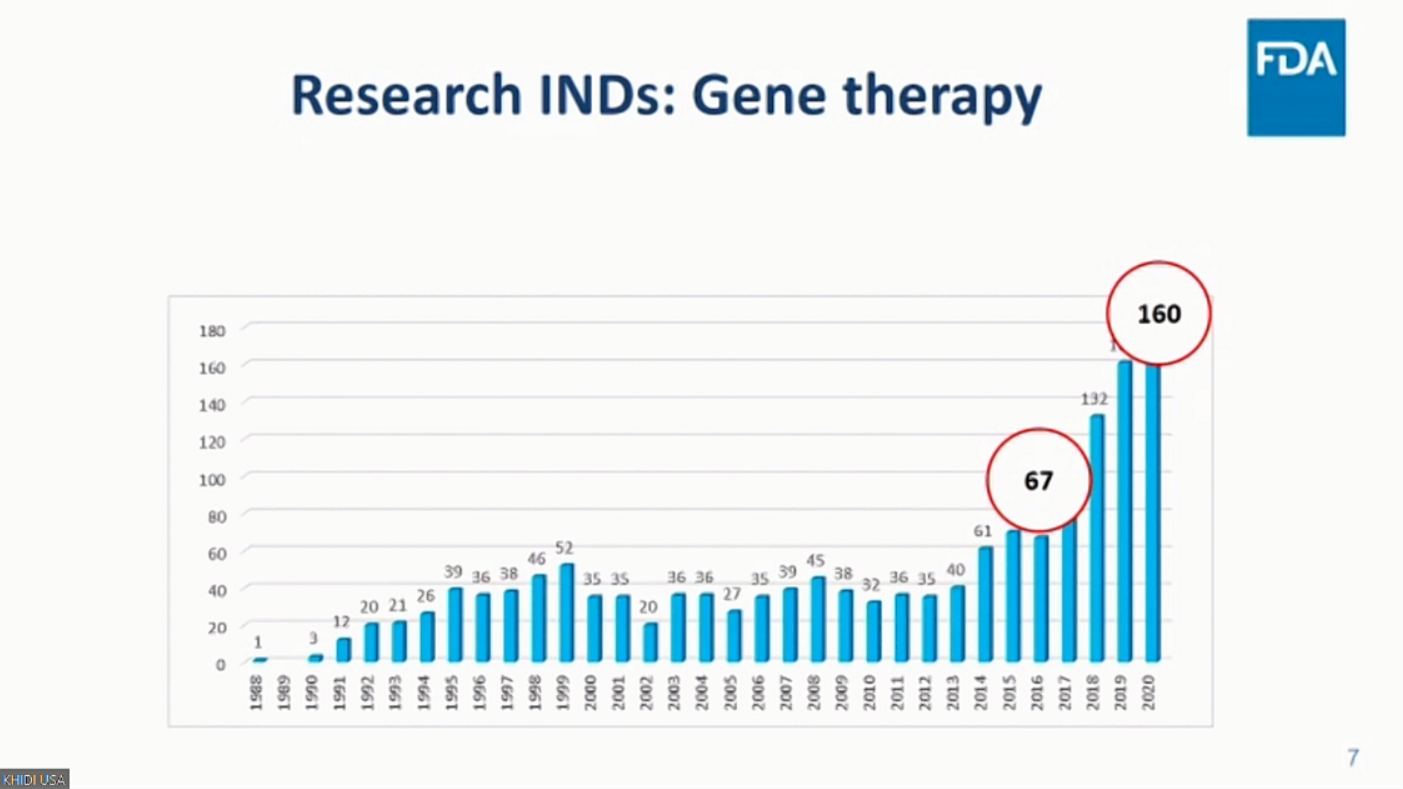
성경은 박사에 따르면 미국 FDA의 OTAT(Office of Tissues and Advanced Therapies)로 신청된 전체 IND 현황으로는 2016년 223건에서 2020년 666건으로 약 200% 이상 증가한 것으로 나타났다.
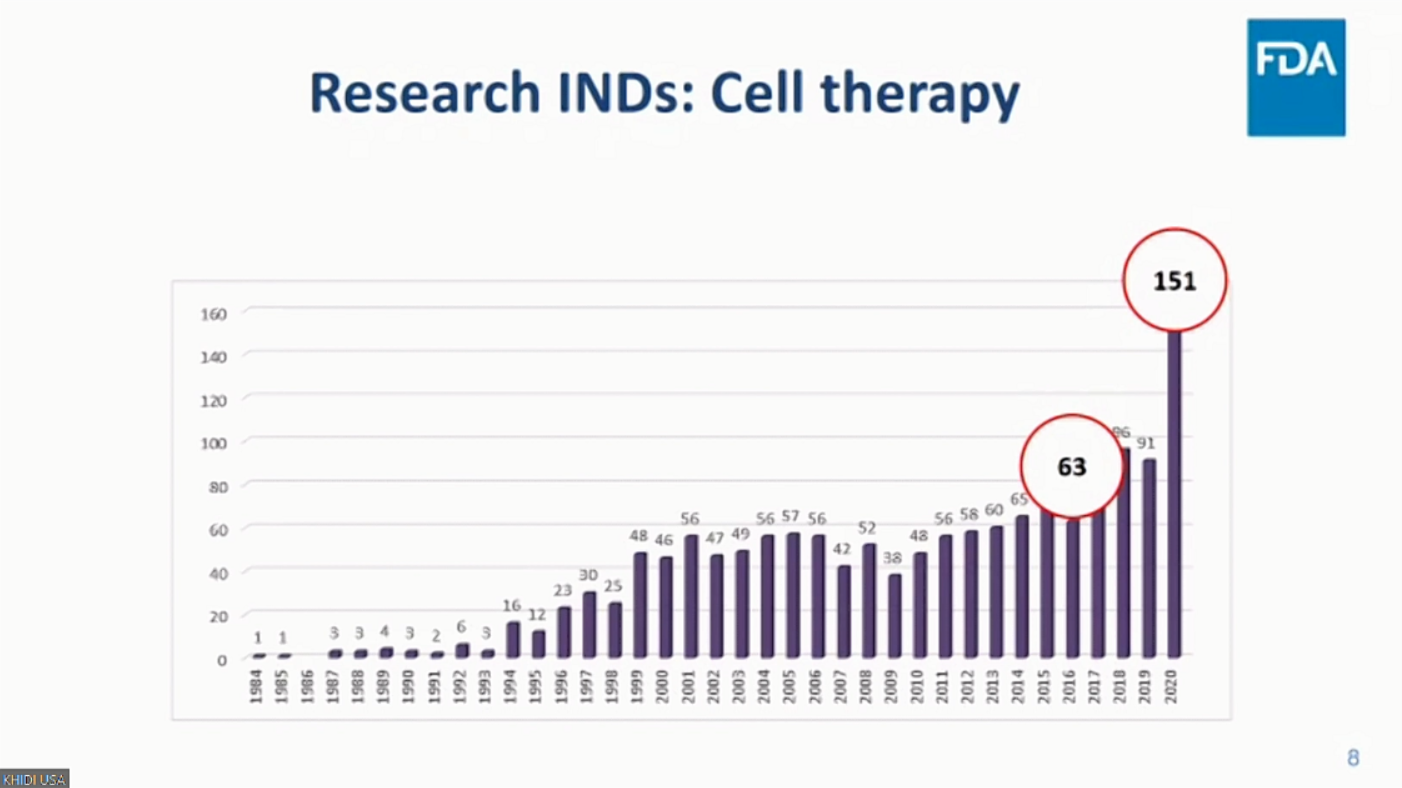
그러나 증가한 IND 신청 건수에 반해, 현재까지 FDA 최종 허가받은 첨단재생의료치료제는 6개로, 허가과정이 매우 복잡하고 어려우며 오랜 기간이 소요되는 것으로 파악됐다. 이에 첨단재생의료치료제 허가를 위한 체계적인 전략이 필요하다고 성경은 박사는 설명했다.
실제 지난 6월 허가받은 `STRATAGRAFT` 제품은 약 20년 전에 임상 1상을 위한 IND 신청을 한 것으로 알려져, 그만큼 허가까지 과정이 험난한 것을 보여준다고 덧붙였다.
또한 현재까지 첨단재생의료치료제 중 Chondrocyte(연골세포), Keratinocyte(각직형성세포), T-Cell, Fibroblast(섬유아세포) 군만 최종 허가받았으며, Multipotent cell(다능세포), Pluripotent cell(만능세포), Stem cell(줄기세포)은 아직 허가받은 제품이 없는 것으로 나타났다고 부연했다.
성경은 박사는 `21st Century cures act: Title III, Section 3033`이 2016년 법률로 제정되면서 첨단재생의료치료제의 FDA 신속심사 제도인 `RMAT(Regenerative Medicine Advanced Therapy)`가 신설됐고, 이에 따라 특별 관리 하에서 허가받을 수 있는 절차가 마련됐다고 설명했다.
아울러 RMAT의 혜택을 받기 위해선 해당 제품이 재생의료에 관련된 제품이어야 하며, 법안에 따라 세포치료제, 세포 요법, 치료조직공학 제품, 인간세포 및 조직제품 또는 이러한 요법이나 제품을 사용하는 모든 조합 제품이어야 한다고 덧붙였다.
또한 FDA에서는 다양한 제품들이 혜택을 볼 수 있도록 해당 법안을 광범위하게 해석하므로, 조건에 따라 유전자치료제도 RMAT 제품으로 해석될 수 있다고 강조했다.
성경은 박사는 “이전에도 Priority Review(우선 심사), Fast Track, Breakthrough Therapy(혁신의약품)와 같은 신속 허가 프로그램이 있었지만, RMAT은 조금 더 특이적인 중증질환을 타깃하는 제품이어야 하고, 예비 임상 증거가 판단의 중점사항”이라고 전했다. 또한 "임상 데이터가 현재로서 충족되지 않은 의료적 요구 사항을 해결할 가능성과 이에 대한 충분한 데이터가 있어야 혜택을 받을 수 있다”고 설명했다.

또한 “RMAT에 해당하는 제품으로 지정받으면 FDA의 담당 부서와 다양한 미팅을 통해, 제품 개발에 있어서 활발한 상호작용을 할 수 있으며, 이에 따른 생산이나 임상시험 단계를 진행할 때도 더 많은 피드백과 도움을 받을 수 있어, 최종 FDA 허가받을 가능성이 높아진다”라고 밝혔다.
한편 지난 3월 31일 기준 RMAT 지정 요청 현황을 살펴보면, 총 168건 중 102건이 거부됐고, 60건이 부여됐으며, 6건이 보류 중인 것으로 나타났다. 거부된 사유를 분석 한 결과, ▲비활성 상태인 IND ▲예비 임상 근거 부족 ▲제조 공정 변경에 따른 자료 부족 ▲재생의료제품 비해당 ▲임상시험 디자인 설정 문제 ▲잘못된 데이터 해석 ▲평가변수 간의 일관성 없는 데이터 ▲임상적으로 불충분한 데이터 등으로 나타났으며, 이 중 예비임상 근거 부족이 가장 많은 거부 사유로 확인됐고 성경은 박사는 설명했다.
아울러 “실제 RMAT 지정을 위한 검토 업무를 진행했을 때, 제품에 대한 임상적 근거가 부족한 경우가 많아, 허가된 경우가 별로 없었다”라며 예비임상 근거의 중요성을 강조했다.
추가로 세포가 가진 특이적인 성질과 이에 따른 제조 공정 단계에 있어서, 검토 시 논란의 여지가 많다며 “환자 개인마다 세포의 성질이 다르고, 특이적인 성질을 가지고 있다. 특히 제한된 저장 기간과 적은 샘플양으로 인해 적합한 분석법을 개발하기 어렵다”고 설명했다. 또한 “인체 내의 세포와 외부의 노출된 세포, 제조 공정을 거친 세포 등은 다양한 위해 요소에 노출됨에 따라 비교했을 시, 상이한 경우가 매우 많아 판단에 어려움이 있다”고 설명했다.
아울러 ”현재 첨단재생의료치료제와 특히 세포치료제에서 표준화되거나 정립된 메커니즘이 많지 않은 상황이므로, 개발자마다 다양한 제조 공정 및 분석법을 제시한다”라며 "향후 FDA 허가를 위해선 적합한 제조 공정 개발과 타당성을 증명할 수 있는 분석법 개발이 함께 진행돼야 한다”고 전했다.
오늘의 헤드라인
전체댓글 0개
등록된 댓글이 없습니다.
| 인기기사 | 더보기 + |
-
1 케어젠, 신규 전달 기술 '히알루로니다제 펩타이드' 최초 공개 -
2 에이비엘바이오-네옥바이오, 'ABL209(NEOK002)' 미국 1상 IND 신청 -
3 로킷헬스케어,경도인지장애·텔로미어 기반 ‘AI 역노화 물질’ 2월 글로벌 상용화 -
4 국내기업 美 자회사 간암 신약 FDA 심사 개시 -
5 2형 당뇨병 치료 GLP-1RA ‘오젬픽’ 급여 등재 -
6 "약가 깎다 필수의약품 끊길판"…외자 제약사 예속화도 가속 -
7 세노비스 키즈, ‘체력튼튼 멀티비타민미네랄’ 리뉴얼 출시 -
8 "3개월 연속 플러스" 바이오헬스 수출 13.5억 달러·전년比 18.3%↑ -
9 아이빔테크놀로지,암 전이 실시간 관찰 성과 세계 최고 권위 ‘Gut’ 지 게재 -
10 [약식동원] 혈액순환 영양제가 따로 없네. 카카오
| 인터뷰 | 더보기 + |
| PEOPLE | 더보기 + |
| 컬쳐/클래시그널 | 더보기 + |

美 '첨단재생의료치료제' IND 200%↑…최종 '단 6품목' 허가
전체 IND 신청 16년 223건→20년 666건·유전자치료제 67→160·세포치료제 63→151
- 권혁진 기자 hjkwon@yakup.com
- 입력 2021.10.18 06:00 수정 2022.01.07 22:20
전 세계적으로 첨단재생의료치료제 개발이 활발히 이뤄지고 있다. 미국 FDA의 OTAT에 신청된 전체 IND 건수가 2020년 기준 666건으로 최대치를 나타냈으며, 올해 이를 돌파할 것이라고 예측되고 있다. 그러나 현재까지 최종 허가받은 품목은 6건에 불과해 허가전략을 재설정할 필요가 있다는 의견이 제시됐다.

주보스턴대한민국총영사관과 한국보건산업진흥원 미국지사가 한미 첨단재생의료 협력 확대를 위한 `첨단재생의료 포럼`을 한국 시간 15일(미국 현지 시간 14일)에 개최했다.
이날 포럼에는 ▲BW BioMed 우정훈 대표 ▲재생의료진흥재단 박소라 이사장 ▲FDA 재생의료 심사역 성경은 박사 ▲Biogen Gene Therapy 그룹장 서혜경 박사 ▲Decibel Therapeutics Senior Scientist 정유진 박사가 참석해 글로벌 첨단재생의료 산업과 한국의 첨단재생의료 산업 발전을 주제로 논의하는 시간을 가졌다.
성경은 박사는 `Regulatory science and CMC considerations for regenerative medicine cellular products`라는 주제로 미국 FDA에서 첨단재생의료치료제에 관한 최신 동향을 소개했다.
성경은 박사는 “유전자치료제와 세포치료제 등 첨단재생의료치료제가 전 세계적으로 많은 관심을 받고 있으며, 이전에는 치료가 불가능했던 희귀질환 치료에 대한 기대로 다양한 신약개발을 위한 움직임이 활발하다”고 산업 동향을 전했다.


성경은 박사에 따르면 미국 FDA의 OTAT(Office of Tissues and Advanced Therapies)로 신청된 전체 IND 현황으로는 2016년 223건에서 2020년 666건으로 약 200% 이상 증가한 것으로 나타났다.

그러나 증가한 IND 신청 건수에 반해, 현재까지 FDA 최종 허가받은 첨단재생의료치료제는 6개로, 허가과정이 매우 복잡하고 어려우며 오랜 기간이 소요되는 것으로 파악됐다. 이에 첨단재생의료치료제 허가를 위한 체계적인 전략이 필요하다고 성경은 박사는 설명했다.
실제 지난 6월 허가받은 `STRATAGRAFT` 제품은 약 20년 전에 임상 1상을 위한 IND 신청을 한 것으로 알려져, 그만큼 허가까지 과정이 험난한 것을 보여준다고 덧붙였다.
또한 현재까지 첨단재생의료치료제 중 Chondrocyte(연골세포), Keratinocyte(각직형성세포), T-Cell, Fibroblast(섬유아세포) 군만 최종 허가받았으며, Multipotent cell(다능세포), Pluripotent cell(만능세포), Stem cell(줄기세포)은 아직 허가받은 제품이 없는 것으로 나타났다고 부연했다.
성경은 박사는 `21st Century cures act: Title III, Section 3033`이 2016년 법률로 제정되면서 첨단재생의료치료제의 FDA 신속심사 제도인 `RMAT(Regenerative Medicine Advanced Therapy)`가 신설됐고, 이에 따라 특별 관리 하에서 허가받을 수 있는 절차가 마련됐다고 설명했다.
아울러 RMAT의 혜택을 받기 위해선 해당 제품이 재생의료에 관련된 제품이어야 하며, 법안에 따라 세포치료제, 세포 요법, 치료조직공학 제품, 인간세포 및 조직제품 또는 이러한 요법이나 제품을 사용하는 모든 조합 제품이어야 한다고 덧붙였다.
또한 FDA에서는 다양한 제품들이 혜택을 볼 수 있도록 해당 법안을 광범위하게 해석하므로, 조건에 따라 유전자치료제도 RMAT 제품으로 해석될 수 있다고 강조했다.
성경은 박사는 “이전에도 Priority Review(우선 심사), Fast Track, Breakthrough Therapy(혁신의약품)와 같은 신속 허가 프로그램이 있었지만, RMAT은 조금 더 특이적인 중증질환을 타깃하는 제품이어야 하고, 예비 임상 증거가 판단의 중점사항”이라고 전했다. 또한 "임상 데이터가 현재로서 충족되지 않은 의료적 요구 사항을 해결할 가능성과 이에 대한 충분한 데이터가 있어야 혜택을 받을 수 있다”고 설명했다.

또한 “RMAT에 해당하는 제품으로 지정받으면 FDA의 담당 부서와 다양한 미팅을 통해, 제품 개발에 있어서 활발한 상호작용을 할 수 있으며, 이에 따른 생산이나 임상시험 단계를 진행할 때도 더 많은 피드백과 도움을 받을 수 있어, 최종 FDA 허가받을 가능성이 높아진다”라고 밝혔다.
한편 지난 3월 31일 기준 RMAT 지정 요청 현황을 살펴보면, 총 168건 중 102건이 거부됐고, 60건이 부여됐으며, 6건이 보류 중인 것으로 나타났다. 거부된 사유를 분석 한 결과, ▲비활성 상태인 IND ▲예비 임상 근거 부족 ▲제조 공정 변경에 따른 자료 부족 ▲재생의료제품 비해당 ▲임상시험 디자인 설정 문제 ▲잘못된 데이터 해석 ▲평가변수 간의 일관성 없는 데이터 ▲임상적으로 불충분한 데이터 등으로 나타났으며, 이 중 예비임상 근거 부족이 가장 많은 거부 사유로 확인됐고 성경은 박사는 설명했다.
아울러 “실제 RMAT 지정을 위한 검토 업무를 진행했을 때, 제품에 대한 임상적 근거가 부족한 경우가 많아, 허가된 경우가 별로 없었다”라며 예비임상 근거의 중요성을 강조했다.
추가로 세포가 가진 특이적인 성질과 이에 따른 제조 공정 단계에 있어서, 검토 시 논란의 여지가 많다며 “환자 개인마다 세포의 성질이 다르고, 특이적인 성질을 가지고 있다. 특히 제한된 저장 기간과 적은 샘플양으로 인해 적합한 분석법을 개발하기 어렵다”고 설명했다. 또한 “인체 내의 세포와 외부의 노출된 세포, 제조 공정을 거친 세포 등은 다양한 위해 요소에 노출됨에 따라 비교했을 시, 상이한 경우가 매우 많아 판단에 어려움이 있다”고 설명했다.
아울러 ”현재 첨단재생의료치료제와 특히 세포치료제에서 표준화되거나 정립된 메커니즘이 많지 않은 상황이므로, 개발자마다 다양한 제조 공정 및 분석법을 제시한다”라며 "향후 FDA 허가를 위해선 적합한 제조 공정 개발과 타당성을 증명할 수 있는 분석법 개발이 함께 진행돼야 한다”고 전했다.
Copyright © Yakup.com All rights reserved.
약업신문 의 모든 컨텐츠(기사)는 저작권법의 보호를 받습니다.
무단 전재·복사·배포 등을 금지합니다.
무단 전재·복사·배포 등을 금지합니다.



 기자가 쓴 기사 더보기
기자가 쓴 기사 더보기
