2021년 해당 지역 바이오기업 시가총액 약 498조7254억원 돌파
전문가들 "한국 바이오 성패, 생태계 설계에 달려 있다" 평가

미국 매사추세츠주 보스턴 바이오 클러스터가 세계 최대 치료제 산업 중심지로 성장한 배경에는 연구·임상·사업화·투자가 유기적으로 맞물린 구조가 자리하고 있다는 분석이 나왔다. 개별 기술이나 특정 기업의 성과보다, 다양한 주체가 연결돼 실패와 재도전을 반복할 수 있는 환경이 산업 경쟁력을 만들어 왔다는 평가다. 이는 한국 바이오 생태계가 무엇을 구축해야 하는지에 대한 질문을 던진다.
영국 카디프대학교(Cardiff University) 비즈니스스쿨 마키 우메무라(Maki Umemura) 선임연구원은 최근 ‘신흥 기술의 치료제 전환: 케임브리지-보스턴 혁신 생태계에서의 보완성과 공진화 추적(Translating Emergent Technologies into Novel Therapeutics: Tracing Complementarity and Co-evolution in the Cambridge-Boston Innovation Ecosystem)’을 제목으로 한 논문을 ‘비즈니스 히스토리 리뷰(Business History Review)’에 발표했다.
이 논문은 미국 매사추세츠주 케임브리지와 보스턴 지역이 어떻게 현대 치료제와 신약 산업의 글로벌 중심지로 자리 잡게 됐는지를 분석했다.
우메무라 박사는 “케임브리지와 보스턴의 경쟁력은 특정 기술이나 몇몇 기업의 성공으로 설명할 수 있는 문제가 아니다”라며 “오랜 시간 쌓여온 지역 기반과 제도 변화, 대학, 병원, 기업, 투자자가 서로 맞물려 성장해 온 구조가 힘이 됐다”라고 분석했다.
그는 이 지역에 세계적 수준의 대학과 병원이 밀집해 있어 연구 성과가 비교적 빠르게 창업과 신약 개발로 이어질 수 있었다고 설명했다. 특허 제도와 기술이전 시스템, 희귀질환 치료제에 대한 인센티브 역시 학계 창업과 바이오 기업 성장을 뒷받침하는 역할을 했다는 평가다.
여기에 장기간의 실패 가능성을 감내할 수 있는 투자 자본과 CRO, 글로벌 제약사가 함께 움직이면서 연구 단계의 기술이 실제 치료제로 이어지는 경로가 반복적으로 만들어질 수 있었다는 분석이다.
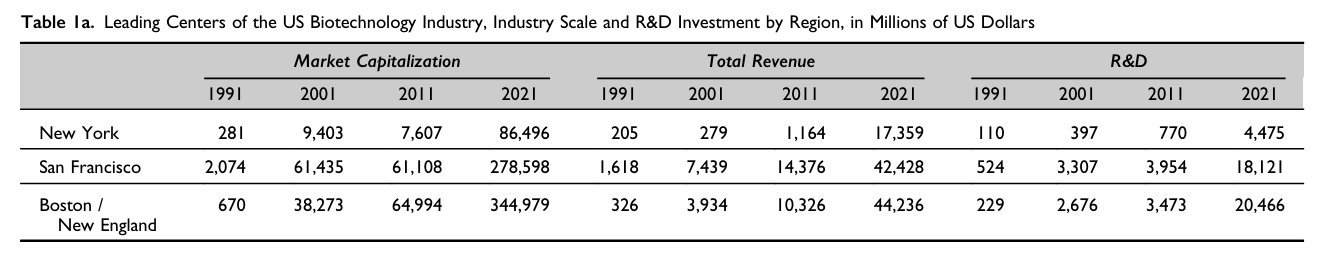
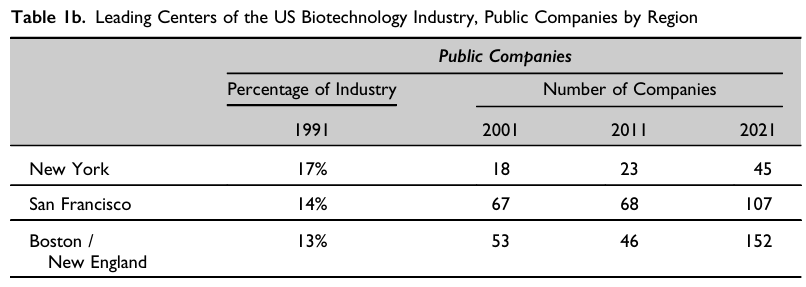
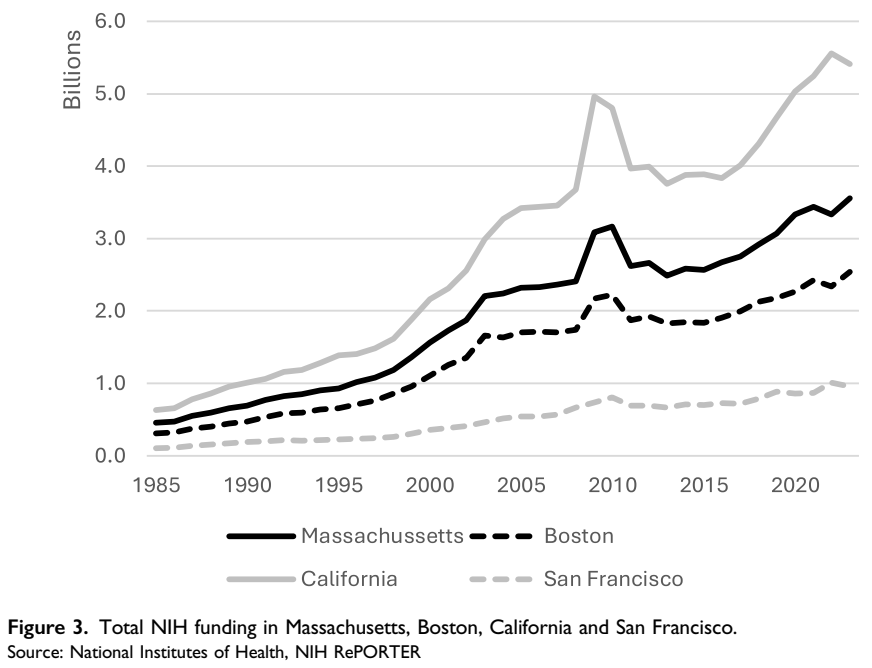
실제 매사추세츠주는 세계 최대 바이오 클러스터로 올라섰다. 바이오테크 상장기업 수와 시가총액, 연구개발(R&D) 지출 규모 모두에서 세계 최고 수준을 기록했다. 2021년 기준, 이 지역 바이오기업의 시가총액은 약 3449억 달러(약 498조7254억원), 연간 R&D 지출은 약 205억 달러(약 29조6430억원)로 집계됐다.
연구·임상·사업화가 한 지역에서
우메무라 박사는 케임브리지와 보스턴의 경쟁력을 △연구·임상을 수용할 수 있는 도시 구조 △대학과 병원이 밀집한 환경 △치료제 산업에 맞춰 설계된 제도 △대학의 적극적인 창업 참여 △장기 실패를 감내하는 자본 생태계로 꼽았다.
이 지역은 20세기 중반 이후 섬유·제조·방산 산업이 쇠퇴하면서 넓은 산업 부지를 확보할 수 있었다. 켄달스퀘어(Kendall Square) 일대는 NASA 전자연구센터가 철수한 뒤 연구시설과 실험실을 조성할 수 있는 드문 도시 공간으로 남았고, 이는 바이오 기업이 모여들 수 있는 출발점이 됐다.
여기에 MIT와 하버드, 하버드의대와 롱우드 의료 클러스터가 가까운 거리에 자리 잡고 있었다. 기초 연구부터 공학, 임상까지 한 지역 안에서 이어질 수 있는 환경이 이미 갖춰져 있었던 셈이다.
산업의 특성도 영향을 미쳤다. 치료제 산업은 개발에 10년 이상이 걸리고 성공 가능성도 높지 않다. 임상 비용과 규제 부담 역시 크다. 한 기업이 모든 단계를 혼자 감당하기는 어렵고, 대학과 병원, 바이오 기업, 제약사, CRO, 투자 자본이 역할을 나눠 협력할 수밖에 없다.
케임브리지와 보스턴은 이런 구조가 작동할 수 있도록 제도적으로 뒷받침됐다. 1980년대 전후로 유전자 기술에 대한 특허가 인정되고, 정부 연구비로 개발된 기술을 민간이 활용할 수 있게 되면서 대학 창업과 바이오 스타트업이 빠르게 늘어났다. 희귀질환 치료제에 대한 인센티브도 신약 개발을 촉진했다.
대학의 역할 변화도 중요한 요인이다. MIT는 기술이전 조직을 단순한 특허 관리 부서에서 벗어나, 사업과 시장을 함께 고민하는 조직으로 전환했다. 교수의 창업과 겸직, 자문 활동도 제도적으로 허용했다.
그 결과, 연구자는 논문을 발표하는 데서 그치지 않고, 창업과 기술 사업화에 적극 나설 수 있었다. 바이오젠과 제네틱스 인스티튜트(Genetics Institute) 같은 기업들은 대학 연구가 실제 신약 개발로 이어지는 연결고리 역할을 했다. 병원 역시 임상시험 수행 기관을 넘어, 초기 임상 설계와 연구 전환의 중심축으로 기능했다.
자본 환경도 함께 성장했다. 초기에는 소규모 투자자 중심이었지만, 이후 바이오 전문 투자사와 제약사 투자 조직, 환자단체 기반 투자, 패밀리오피스까지 참여하는 구조로 확대됐다. 장기적인 실패 가능성을 감수할 수 있는 자본이 축적되면서, 한 번의 성공이 아니라 여러 차례의 도전을 이어갈 수 있는 환경이 만들어졌다.
우메무라 박사는 “치료제 산업은 개발에 오랜 시간이 걸리고 실패 확률도 높아, 한 번의 성공을 전제로 한 방식으로는 지속되기 어렵다”면서 “케임브리지와 보스턴은 개별 성과보다 실패와 재도전을 받아들이는 환경 자체가 경쟁력이 된 대표적인 사례”라고 평가했다.
한국 바이오의 한계, 연결되지 않은 구조
그렇다면 한국은 왜 아직 같은 생태계를 만들지 못했을까. 업계 관계자는 “한국 역시 우수한 연구자와 일부 경쟁력 있는 기업을 보유하고 있으나, 구조는 다르다”며 “연구는 대학에, 임상은 병원에, 사업화는 기업에 분절돼 있고, 이를 장기적으로 연결하는 제도와 자본은 취약하다”라고 지적했다.
즉, 기술은 있으나 실제 신약개발까지 이어지는 구조가 여전히 부족하다는 지적이다. 실제 한국은 인천 송도, 충북 오송, 경기 판교, 대전, 대구·경북, 전북, 강원 등 지역별 바이오 클러스터를 잇달아 조성하고 있다. 그러나 각 주체가 장기적으로 연결돼 순환하는 생태계로 작동한다고 보기는 어렵다는 평가가 나온다.
또한 그는 “기술이전은 여전히 행정 중심이고, 교수 창업은 개인의 리스크로 남아 있다”라며 “임상 인프라는 치료 중심으로 설계돼 초기 임상과 전환 연구의 유연성이 낮고, 자본은 단기 회수 논리에 민감하다”라고 말했다.
최근 한국에도 의미 있는 변화 조짐이 나타나고 있다. 대표적인 사례가 대전 바이오헬스케어협회(BioHA)를 중심으로 형성된 대전 바이오 클러스터다.
2015년 대전 인근 15개 바이오벤처가 뜻을 모아 출범한 협회는 연구 역량은 강하지만 산업과 자본 연결이 약하다는 지역의 한계를 극복하겠다는 문제의식에서 출발했다. 당시만 해도 대전은 창업 이후 기업이 성장하려면 수도권으로 이동해야 한다는 인식이 강했던 지역이었다.
협회는 지난 10년간 대학과 연구기관, 기업, 병원, 투자자를 연결하는 플랫폼 역할에 집중해 왔다. 단순한 기업 모임을 넘어 네트워킹과 기술 교류, 투자 포럼, IR 연계, 민간 투자조합 결성 등 기업 성장 단계별 프로그램을 운영하며 연구 성과가 사업과 자본으로 이어질 수 있는 경로를 만들어 왔다.
그 결과, 현재 163개 회원사가 참여하는 국내 최대 규모의 지역 바이오 생태계로 성장했고, 이 가운데 상장사는 29곳, 회원 상장사 시가총액 합계는 약 53조원에 달한다. 알테오젠, 리가켐바이오사이언스, 큐로셀, 펩트론 등 주요 기업들이 이 생태계 안에서 성장했다.
대전 사례의 의미는 특정 앵커 기업이나 단일 연구기관에 의존하지 않았다는 점에 있다. 협회를 중심으로 연구, 개발, 임상, 사업화, 투자로 이어지는 흐름이 지역 단위에서 작동하기 시작했고, 기업과 자본이 반복적으로 만나고 협력하는 구조가 자리 잡았다.
케임브리지와 보스턴 바이오 클러스터의 성공 요인으로 꼽히는 연결 구조가 대전 바이오 클러스터를 통해 한국에서도 충분히 구현될 수 있다는 것을 보여준 것이다.
협회 관계자는 “현대 치료제 산업의 경쟁력은 실패를 흡수하고 다음 도전을 가능하게 하는 생태계에서 나온다”며 “한국에 필요한 것은 하나의 유망 파이프라인이 아니라, 기술을 실제 약으로 바꾸는 구조 자체”라고 말했다.
이어 그는 “정부 역시 단기 성과 중심의 지원을 넘어, 연구, 임상, 사업화, 투자가 유기적으로 이어질 수 있도록 제도와 인프라를 설계해야 한다”라며 “이 같은 구조가 만들어지지 않는다면, 글로벌 치료제 산업의 중심은 앞으로도 다른 지역의 몫으로 남을 가능성이 크다”고 덧붙였다.
| 인기기사 | 더보기 + |
-
1 "연결과 단절" 보스턴 바이오클러스터가 던진 한국 바이오의 과제 -
2 연말에도 멈추지 않은 라이선스 거래…빅파마 선택은 '항암' -
3 [분석] 약사사회 현안, 성과의 시간으로 향하나…집행부 '시험대' -
4 ‘K-뷰티의 마스터피스’ ① 아모레퍼시픽 R&I 센터 -
5 알지노믹스, 맞춤형 심장질환 치료제 개발 나선다 -
6 한림제약, 김정진 부회장 '회장' 승진...2026년 임원 인사 단행 -
7 애브비, 중국 제약사와 폐암 치료제 전략적 제휴 -
8 씨엔알리서치, 노바바이오 ‘잇몸 생체적합성 필러 임상’ 계약 체결 -
9 오름 테라퓨틱스,채드 메이 최고 과학 책임자 임명 -
10 이주혁 대표 “소아 희귀안질환, 신생아 선별검사·첨단재생의료 해법”
| 인터뷰 | 더보기 + |
| PEOPLE | 더보기 + |
| 컬쳐/클래시그널 | 더보기 + |

- 권혁진 기자 hjkwon@yakup.com
- 입력 2026.01.05 06:00 수정 2026.01.05 09:09

미국 매사추세츠주 보스턴 바이오 클러스터가 세계 최대 치료제 산업 중심지로 성장한 배경에는 연구·임상·사업화·투자가 유기적으로 맞물린 구조가 자리하고 있다는 분석이 나왔다. 개별 기술이나 특정 기업의 성과보다, 다양한 주체가 연결돼 실패와 재도전을 반복할 수 있는 환경이 산업 경쟁력을 만들어 왔다는 평가다. 이는 한국 바이오 생태계가 무엇을 구축해야 하는지에 대한 질문을 던진다.
영국 카디프대학교(Cardiff University) 비즈니스스쿨 마키 우메무라(Maki Umemura) 선임연구원은 최근 ‘신흥 기술의 치료제 전환: 케임브리지-보스턴 혁신 생태계에서의 보완성과 공진화 추적(Translating Emergent Technologies into Novel Therapeutics: Tracing Complementarity and Co-evolution in the Cambridge-Boston Innovation Ecosystem)’을 제목으로 한 논문을 ‘비즈니스 히스토리 리뷰(Business History Review)’에 발표했다.
이 논문은 미국 매사추세츠주 케임브리지와 보스턴 지역이 어떻게 현대 치료제와 신약 산업의 글로벌 중심지로 자리 잡게 됐는지를 분석했다.
우메무라 박사는 “케임브리지와 보스턴의 경쟁력은 특정 기술이나 몇몇 기업의 성공으로 설명할 수 있는 문제가 아니다”라며 “오랜 시간 쌓여온 지역 기반과 제도 변화, 대학, 병원, 기업, 투자자가 서로 맞물려 성장해 온 구조가 힘이 됐다”라고 분석했다.
그는 이 지역에 세계적 수준의 대학과 병원이 밀집해 있어 연구 성과가 비교적 빠르게 창업과 신약 개발로 이어질 수 있었다고 설명했다. 특허 제도와 기술이전 시스템, 희귀질환 치료제에 대한 인센티브 역시 학계 창업과 바이오 기업 성장을 뒷받침하는 역할을 했다는 평가다.
여기에 장기간의 실패 가능성을 감내할 수 있는 투자 자본과 CRO, 글로벌 제약사가 함께 움직이면서 연구 단계의 기술이 실제 치료제로 이어지는 경로가 반복적으로 만들어질 수 있었다는 분석이다.
실제 매사추세츠주는 세계 최대 바이오 클러스터로 올라섰다. 바이오테크 상장기업 수와 시가총액, 연구개발(R&D) 지출 규모 모두에서 세계 최고 수준을 기록했다. 2021년 기준, 이 지역 바이오기업의 시가총액은 약 3449억 달러(약 498조7254억원), 연간 R&D 지출은 약 205억 달러(약 29조6430억원)로 집계됐다.


연구·임상·사업화가 한 지역에서
우메무라 박사는 케임브리지와 보스턴의 경쟁력을 △연구·임상을 수용할 수 있는 도시 구조 △대학과 병원이 밀집한 환경 △치료제 산업에 맞춰 설계된 제도 △대학의 적극적인 창업 참여 △장기 실패를 감내하는 자본 생태계로 꼽았다.
이 지역은 20세기 중반 이후 섬유·제조·방산 산업이 쇠퇴하면서 넓은 산업 부지를 확보할 수 있었다. 켄달스퀘어(Kendall Square) 일대는 NASA 전자연구센터가 철수한 뒤 연구시설과 실험실을 조성할 수 있는 드문 도시 공간으로 남았고, 이는 바이오 기업이 모여들 수 있는 출발점이 됐다.
여기에 MIT와 하버드, 하버드의대와 롱우드 의료 클러스터가 가까운 거리에 자리 잡고 있었다. 기초 연구부터 공학, 임상까지 한 지역 안에서 이어질 수 있는 환경이 이미 갖춰져 있었던 셈이다.
산업의 특성도 영향을 미쳤다. 치료제 산업은 개발에 10년 이상이 걸리고 성공 가능성도 높지 않다. 임상 비용과 규제 부담 역시 크다. 한 기업이 모든 단계를 혼자 감당하기는 어렵고, 대학과 병원, 바이오 기업, 제약사, CRO, 투자 자본이 역할을 나눠 협력할 수밖에 없다.
케임브리지와 보스턴은 이런 구조가 작동할 수 있도록 제도적으로 뒷받침됐다. 1980년대 전후로 유전자 기술에 대한 특허가 인정되고, 정부 연구비로 개발된 기술을 민간이 활용할 수 있게 되면서 대학 창업과 바이오 스타트업이 빠르게 늘어났다. 희귀질환 치료제에 대한 인센티브도 신약 개발을 촉진했다.
대학의 역할 변화도 중요한 요인이다. MIT는 기술이전 조직을 단순한 특허 관리 부서에서 벗어나, 사업과 시장을 함께 고민하는 조직으로 전환했다. 교수의 창업과 겸직, 자문 활동도 제도적으로 허용했다.
그 결과, 연구자는 논문을 발표하는 데서 그치지 않고, 창업과 기술 사업화에 적극 나설 수 있었다. 바이오젠과 제네틱스 인스티튜트(Genetics Institute) 같은 기업들은 대학 연구가 실제 신약 개발로 이어지는 연결고리 역할을 했다. 병원 역시 임상시험 수행 기관을 넘어, 초기 임상 설계와 연구 전환의 중심축으로 기능했다.
자본 환경도 함께 성장했다. 초기에는 소규모 투자자 중심이었지만, 이후 바이오 전문 투자사와 제약사 투자 조직, 환자단체 기반 투자, 패밀리오피스까지 참여하는 구조로 확대됐다. 장기적인 실패 가능성을 감수할 수 있는 자본이 축적되면서, 한 번의 성공이 아니라 여러 차례의 도전을 이어갈 수 있는 환경이 만들어졌다.
우메무라 박사는 “치료제 산업은 개발에 오랜 시간이 걸리고 실패 확률도 높아, 한 번의 성공을 전제로 한 방식으로는 지속되기 어렵다”면서 “케임브리지와 보스턴은 개별 성과보다 실패와 재도전을 받아들이는 환경 자체가 경쟁력이 된 대표적인 사례”라고 평가했다.

한국 바이오의 한계, 연결되지 않은 구조
그렇다면 한국은 왜 아직 같은 생태계를 만들지 못했을까. 업계 관계자는 “한국 역시 우수한 연구자와 일부 경쟁력 있는 기업을 보유하고 있으나, 구조는 다르다”며 “연구는 대학에, 임상은 병원에, 사업화는 기업에 분절돼 있고, 이를 장기적으로 연결하는 제도와 자본은 취약하다”라고 지적했다.
즉, 기술은 있으나 실제 신약개발까지 이어지는 구조가 여전히 부족하다는 지적이다. 실제 한국은 인천 송도, 충북 오송, 경기 판교, 대전, 대구·경북, 전북, 강원 등 지역별 바이오 클러스터를 잇달아 조성하고 있다. 그러나 각 주체가 장기적으로 연결돼 순환하는 생태계로 작동한다고 보기는 어렵다는 평가가 나온다.
또한 그는 “기술이전은 여전히 행정 중심이고, 교수 창업은 개인의 리스크로 남아 있다”라며 “임상 인프라는 치료 중심으로 설계돼 초기 임상과 전환 연구의 유연성이 낮고, 자본은 단기 회수 논리에 민감하다”라고 말했다.
최근 한국에도 의미 있는 변화 조짐이 나타나고 있다. 대표적인 사례가 대전 바이오헬스케어협회(BioHA)를 중심으로 형성된 대전 바이오 클러스터다.
2015년 대전 인근 15개 바이오벤처가 뜻을 모아 출범한 협회는 연구 역량은 강하지만 산업과 자본 연결이 약하다는 지역의 한계를 극복하겠다는 문제의식에서 출발했다. 당시만 해도 대전은 창업 이후 기업이 성장하려면 수도권으로 이동해야 한다는 인식이 강했던 지역이었다.
협회는 지난 10년간 대학과 연구기관, 기업, 병원, 투자자를 연결하는 플랫폼 역할에 집중해 왔다. 단순한 기업 모임을 넘어 네트워킹과 기술 교류, 투자 포럼, IR 연계, 민간 투자조합 결성 등 기업 성장 단계별 프로그램을 운영하며 연구 성과가 사업과 자본으로 이어질 수 있는 경로를 만들어 왔다.
그 결과, 현재 163개 회원사가 참여하는 국내 최대 규모의 지역 바이오 생태계로 성장했고, 이 가운데 상장사는 29곳, 회원 상장사 시가총액 합계는 약 53조원에 달한다. 알테오젠, 리가켐바이오사이언스, 큐로셀, 펩트론 등 주요 기업들이 이 생태계 안에서 성장했다.
대전 사례의 의미는 특정 앵커 기업이나 단일 연구기관에 의존하지 않았다는 점에 있다. 협회를 중심으로 연구, 개발, 임상, 사업화, 투자로 이어지는 흐름이 지역 단위에서 작동하기 시작했고, 기업과 자본이 반복적으로 만나고 협력하는 구조가 자리 잡았다.
케임브리지와 보스턴 바이오 클러스터의 성공 요인으로 꼽히는 연결 구조가 대전 바이오 클러스터를 통해 한국에서도 충분히 구현될 수 있다는 것을 보여준 것이다.
협회 관계자는 “현대 치료제 산업의 경쟁력은 실패를 흡수하고 다음 도전을 가능하게 하는 생태계에서 나온다”며 “한국에 필요한 것은 하나의 유망 파이프라인이 아니라, 기술을 실제 약으로 바꾸는 구조 자체”라고 말했다.
이어 그는 “정부 역시 단기 성과 중심의 지원을 넘어, 연구, 임상, 사업화, 투자가 유기적으로 이어질 수 있도록 제도와 인프라를 설계해야 한다”라며 “이 같은 구조가 만들어지지 않는다면, 글로벌 치료제 산업의 중심은 앞으로도 다른 지역의 몫으로 남을 가능성이 크다”고 덧붙였다.
무단 전재·복사·배포 등을 금지합니다.



 기자가 쓴 기사 더보기
기자가 쓴 기사 더보기
