 기자가 쓴 기사 더보기
기자가 쓴 기사 더보기
식품의약품안전처(처장 손문기)는 무릎 골관절염 치료제로 국내에서 처음 개발된 유전자치료제 신약 ‘인보사케이주’를 7월 12일 허가했다고 밝혔다.
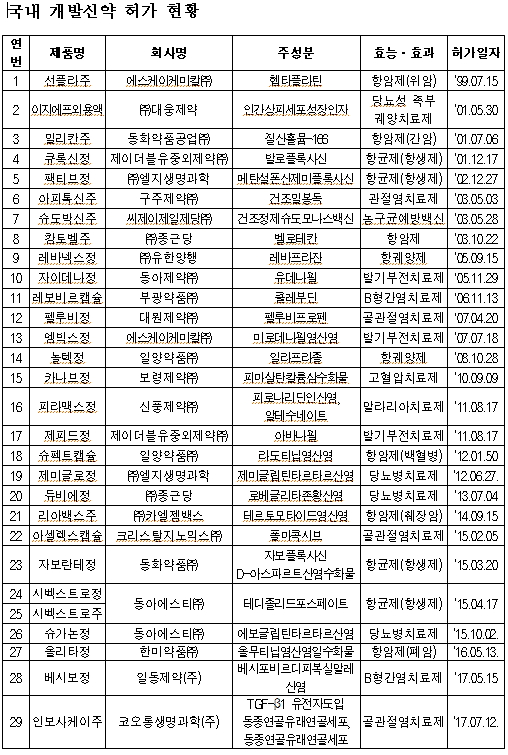
유전자치료제는 유전물질 발현에 영향을 주기 위해 투여하는 유전물질 또는 유전물질이 변형되거나 도입된 세포를 함유하고 있는 의약품으로 코오롱생명과학의 '인보사케이주'는 항염증 작용을 나타내는 'TGF-β1 유전자'가 도입된 동종연골유래연골세포를 주성분으로 하며, 국내 신약으로는 29번째다.
'인보사케이주'의 효능·효과는 약물치료나 물리치료에도 불구하고 통증 등이 지속되는 중등도(Kellgren & Lawrence grade 3) 무릎 골관절염환자의 치료이며, 무릎관절강내 1회 주사한다.
현재까지 미국, 유럽 등 주요 제약선진국이 허가한 유전자치료제는 4개 품목으로 면역결핍질환, 유전질환이나 항암치료를 목적으로 사용되며, 퇴행성 질환인 무릎 골관절염 치료를 위한 유전자치료제는 인보사케이주가 처음이다.
식약처는 인보사케이주를 허가·심사하는 단계에서 △해당제품 투여 후 통증과 관절기능 개선 정도 △연골 구조 개선 효과 △제품 투여 후 발생하는 이상반응 △제품 투여 후 장기추적조사를 통해 뒤늦게 나타나는 이상반응 등 자료를 중점적으로 검토했으며, 중앙약사심의위원회의 자문을 거쳐 최종 허가를 결정했다고 설명했다.
유효성의 경우 중등도의 무릎 골관절염 환자를 대상으로 해당 제품을 1회 주사하고 1년 후 환자가 느끼는 무릎 통증 개선정도와 운동이나 일상생활 등에서의 기능 개선정도를 대조군(생리식염수 투여군)과 비교한 결과 유효성을 입증했다.
안전성의 경우 주사부위 국소반응(통증, 부종 등)과 전신반응(열감, 두드러기 등)을 평가하였을 때 안전했으며, 해당 제품을 투여한 100여명 환자 각각을 3∼10년간 별도로 추적 조사한 임상시험에서 지연 반응(종양, TGF-β1 농도 상승 등) 등을 평가한 결과에서도 안전했다고 식약처는 밝혔다.
한편, 식약처는 지난 2014년부터 바이오업체의 개발을 지원하기 위해 '마중물사업'을 운영하고 있으며, 이번 유전자치료제도 ‘마중물사업’을 통해 품질관리 기준 설정 등에 대한 밀착상담을 받아 개발 과정 중 시행착오를 최소화 할 수 있었다고 설명했다.
| 인기기사 | 더보기 + |
-
1 보로노이, 'VRN10' 임상 1상 데이터 공개..."초기 용량부터 항종양 효과 확인" -
2 화장품 기업 80개사 3Q 누적 해외매출 및 수출 평균 1157억…전년비 20.5%↑ -
3 11월 임상 키워드 ‘포트폴리오 재편’…셀트리온 확장, 종근당·동국제약 강화 -
4 '제약바이오산업 제조혁신'...스마트팩토리 고도화·CDMO 생태계 육성 '특명' -
5 "아리바이오 'AR1001', 알츠하이머 미충족 의료 수요 해결 혁신 경구치료제" -
6 "CDMO 특별법, '반쪽짜리' 안 되려면 R&D·품질 관리도 세제 지원해야" -
7 김태식 전 한국유나이티드제약 전무, 강남구 명예구민 선정 -
8 [ODC25 ASEAN] 오가노이드사이언스, ‘과학이 문화가 되는’ 새 장 열다 -
9 [ODC25 ASEAN]"아세안 바이오 지각변동" 한국 오가노이드, 태국과 만나 확장 가속 -
10 미국 남성 뷰티 공략 K-뷰티, 전신용·다기능·SNS 마케팅 주목해야
| 인터뷰 | 더보기 + |
| PEOPLE | 더보기 + |
| 컬쳐/클래시그널 | 더보기 + |

- 김용주 기자 yjkim@yakup.com
- 입력 2017.07.12 09:07 수정 2017.07.12 09:07
식품의약품안전처(처장 손문기)는 무릎 골관절염 치료제로 국내에서 처음 개발된 유전자치료제 신약 ‘인보사케이주’를 7월 12일 허가했다고 밝혔다.
유전자치료제는 유전물질 발현에 영향을 주기 위해 투여하는 유전물질 또는 유전물질이 변형되거나 도입된 세포를 함유하고 있는 의약품으로 코오롱생명과학의 '인보사케이주'는 항염증 작용을 나타내는 'TGF-β1 유전자'가 도입된 동종연골유래연골세포를 주성분으로 하며, 국내 신약으로는 29번째다.
'인보사케이주'의 효능·효과는 약물치료나 물리치료에도 불구하고 통증 등이 지속되는 중등도(Kellgren & Lawrence grade 3) 무릎 골관절염환자의 치료이며, 무릎관절강내 1회 주사한다.
현재까지 미국, 유럽 등 주요 제약선진국이 허가한 유전자치료제는 4개 품목으로 면역결핍질환, 유전질환이나 항암치료를 목적으로 사용되며, 퇴행성 질환인 무릎 골관절염 치료를 위한 유전자치료제는 인보사케이주가 처음이다.
식약처는 인보사케이주를 허가·심사하는 단계에서 △해당제품 투여 후 통증과 관절기능 개선 정도 △연골 구조 개선 효과 △제품 투여 후 발생하는 이상반응 △제품 투여 후 장기추적조사를 통해 뒤늦게 나타나는 이상반응 등 자료를 중점적으로 검토했으며, 중앙약사심의위원회의 자문을 거쳐 최종 허가를 결정했다고 설명했다.
유효성의 경우 중등도의 무릎 골관절염 환자를 대상으로 해당 제품을 1회 주사하고 1년 후 환자가 느끼는 무릎 통증 개선정도와 운동이나 일상생활 등에서의 기능 개선정도를 대조군(생리식염수 투여군)과 비교한 결과 유효성을 입증했다.
안전성의 경우 주사부위 국소반응(통증, 부종 등)과 전신반응(열감, 두드러기 등)을 평가하였을 때 안전했으며, 해당 제품을 투여한 100여명 환자 각각을 3∼10년간 별도로 추적 조사한 임상시험에서 지연 반응(종양, TGF-β1 농도 상승 등) 등을 평가한 결과에서도 안전했다고 식약처는 밝혔다.
한편, 식약처는 지난 2014년부터 바이오업체의 개발을 지원하기 위해 '마중물사업'을 운영하고 있으며, 이번 유전자치료제도 ‘마중물사업’을 통해 품질관리 기준 설정 등에 대한 밀착상담을 받아 개발 과정 중 시행착오를 최소화 할 수 있었다고 설명했다.

무단 전재·복사·배포 등을 금지합니다.



