 기자가 쓴 기사 더보기
기자가 쓴 기사 더보기
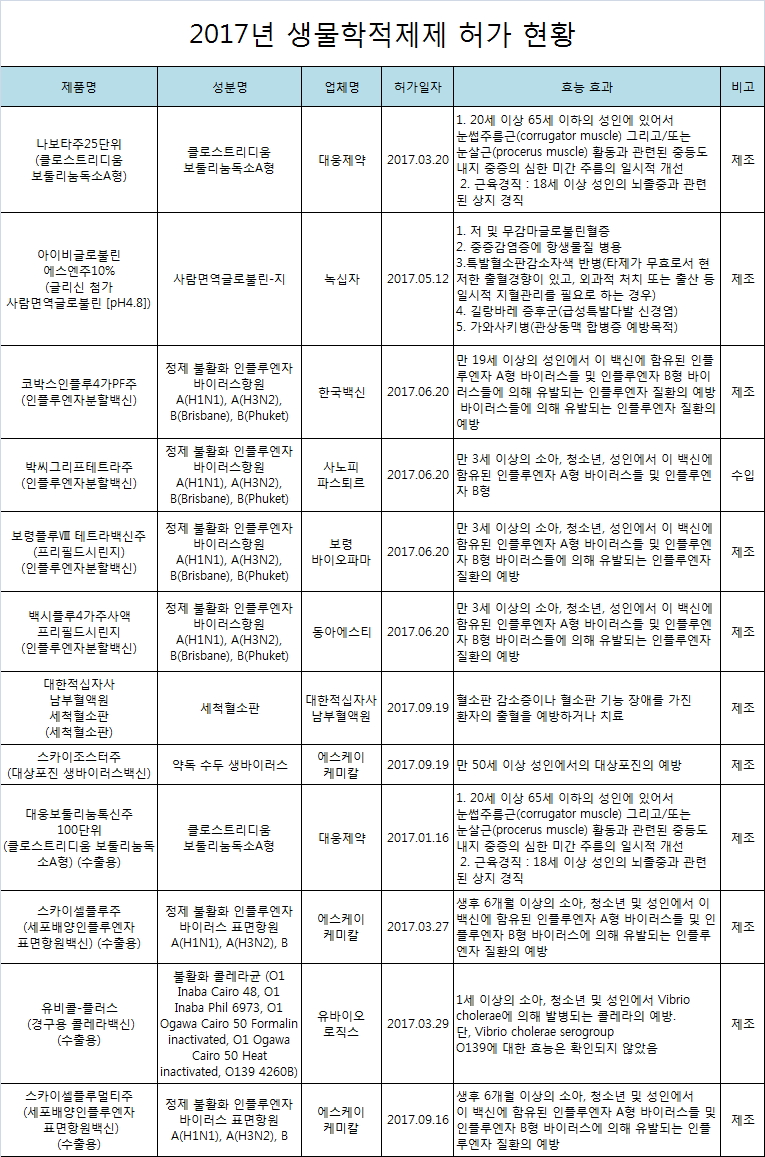
지난해 인플루엔자백신 6품목을 비롯해 총 12품목의 생물학적제제가 허가를 받은 것으로 집계됐다.
식품의약품안전처는 최근 발간한 '2017년 의약품 허가보고서'를 통해 지난해 허가된 생물학적제제는 12품목이었다고 밝혔다.
허가된 생물학적 제제로 유형별로 살펴보면 백신 8품목, 보툴리눔 독소 2품목, 혈액제제 2품목 등이었다.
연도별 생물학적제제 허가현황은 2016년 11품목(백신 8품목, 보툴리눔 독소 2품목, 혈액제제 1품목), 2016년 20품목(백신 16품목, 보툴리눔 독소 4품목)이었다.
지난해 허가된 백신의 경우, 제제별로는 인플루엔자 백신 6품목, 대상포진 백신 1품목, 콜레라 백신 1품목으로 파악됐다.
인플루엔자 백신의 경우 인플루엔자 백신에 포함된 B형 바이러스와 실제 유행하는 B형 바이러스의 불일치를 해소하기 위하여 세계보건기구(WHO) 에서는 4가지 종류(A(H1N1, H3N2), B('Yamagata'와 'Victoria' 계통 모두 포함))의 바이러스를 함유한 4가 인플루엔자 백신 개발을 권고하고 있다.
2017년 내수용 허가 품목 모두 4가 인플루엔자 예방 백신 제품들이었으며, 한국백신의 '코박스인플루4가PF주', 사노피파스퇴르의 '박씨그리프테트라주', 보령바이오파마의 '보령플루VIII테트라백신주(프리필드시린지)', 동아에스티(주)의 '백시플루4가주사액프리필드시린지'가 허가됐다.
또 2017년 수출용 허가 품목인 '스카이셀플루주', '스카이셀플루멀티주'는 모두 에스케이케미칼의 품목으로 3가 인플루엔자 예방 백신이다.
계절 인플루엔자 백신은 2017년도에 6품목의 완제의약품이 추가로 되면서 총 61품품목이 허가를 받았다.
에스케이케미칼(주)의 '스카이조스터주'는 국내 자체 기술로는 최초로 개발된 대상포진 백신이며, 식약처가 운영하는 '글로벌 백신 제품화 지원단'에서 맞춤형 컨설팅을 통해 국산 백신 자급화를 거둔 제품이다. 이 제품은 만 50세 이상 성인에서의 대상포진 예방을 목적으로 접종되는 백신이다.
㈜유바이오로직스의 '유비콜-플러스'는 수출용 경구용 콜레라 예방 백신이며, 동일한 효능·효과를 가진 기허가 제품을 다른 용기로 개발한 제품이다.
보툴리눔 제제의 경우, 2015년도에는 2품목, 2016년 4품목, 2017년도에는 2품목이 신규로 허가받았다.
대웅제약의 '나보타주25단위'는 동일한 효능·효과를 가진 기허가 제품을 다른 단위로 개발한 제품이며, '대웅보툴리눔톡신주100단위'는 동일한 효능·효과를 가진 기허가 제품을 수출용 품목으로 허가받은 제품이다.
혈액제제의 경우, 2016년도에 허가 받은 품목이 없었던데 비해, 2017년도에는 혈장분획제제 1품목, 혈액성분제제 1품목이 허가를 받았다.
녹십자의 글리신 첨가 사람면역글로불린 제제인 '아이비글로불린 에스엔주10%'는 기허가 제품에 비해 사람면역글로불린-지 함량을 증량하고 안정제를 변경한 제품이다.
대한적십자사남부혈액원의 '대한적십자사남부혈액원세척혈소판'은 백혈구 제거성분채혈혈소판을 이용하여 제조한 신규 혈액성분제제이다.
| 인기기사 | 더보기 + |
-
1 경구용 위고비 출시 효과 '와우!'…먹는 GLP-1 시대 개막 -
2 세포·유전자치료제 ‘제2의 전성기’ 신호탄 -
3 "입 열었다" 에이비엘 이상훈 대표 “사노피 'ABL301' 우선순위 조정, 성공률 향상 과정일 뿐” -
4 파멥신 유진산 창업자 “상장폐지 후, 기술기업은 누가 지켜주는가” -
5 HLB, 간암 신약 FDA '클래스2' 본심사 시작…"7월 최종 결정" -
6 "효과 떨어진 이유, 정말 내성뿐일까" 현대바이오 '페니트리움'이 던진 질문 -
7 [약업분석]HLB그룹, 전년3Q 연구개발비 확대…상품·해외매출 증가 -
8 [기고]골목대장을 넘어 글로벌 리더로, “K-Pharma 도약, 지금이 골든타임” -
9 "거짓 정보에 흔들리지 않아" 에이비엘바이오, 사노피 ‘ABL301’ 공식입장 발표 -
10 창고형 약국 확산에…약사들 "이대로는 안 된다"
| 인터뷰 | 더보기 + |
| PEOPLE | 더보기 + |
| 컬쳐/클래시그널 | 더보기 + |

- 김용주 기자 yjkim@yakup.com
- 입력 2018.06.08 12:10 수정 2018.06.08 12:13
지난해 인플루엔자백신 6품목을 비롯해 총 12품목의 생물학적제제가 허가를 받은 것으로 집계됐다.
식품의약품안전처는 최근 발간한 '2017년 의약품 허가보고서'를 통해 지난해 허가된 생물학적제제는 12품목이었다고 밝혔다.
허가된 생물학적 제제로 유형별로 살펴보면 백신 8품목, 보툴리눔 독소 2품목, 혈액제제 2품목 등이었다.
연도별 생물학적제제 허가현황은 2016년 11품목(백신 8품목, 보툴리눔 독소 2품목, 혈액제제 1품목), 2016년 20품목(백신 16품목, 보툴리눔 독소 4품목)이었다.
지난해 허가된 백신의 경우, 제제별로는 인플루엔자 백신 6품목, 대상포진 백신 1품목, 콜레라 백신 1품목으로 파악됐다.
인플루엔자 백신의 경우 인플루엔자 백신에 포함된 B형 바이러스와 실제 유행하는 B형 바이러스의 불일치를 해소하기 위하여 세계보건기구(WHO) 에서는 4가지 종류(A(H1N1, H3N2), B('Yamagata'와 'Victoria' 계통 모두 포함))의 바이러스를 함유한 4가 인플루엔자 백신 개발을 권고하고 있다.
2017년 내수용 허가 품목 모두 4가 인플루엔자 예방 백신 제품들이었으며, 한국백신의 '코박스인플루4가PF주', 사노피파스퇴르의 '박씨그리프테트라주', 보령바이오파마의 '보령플루VIII테트라백신주(프리필드시린지)', 동아에스티(주)의 '백시플루4가주사액프리필드시린지'가 허가됐다.
또 2017년 수출용 허가 품목인 '스카이셀플루주', '스카이셀플루멀티주'는 모두 에스케이케미칼의 품목으로 3가 인플루엔자 예방 백신이다.
계절 인플루엔자 백신은 2017년도에 6품목의 완제의약품이 추가로 되면서 총 61품품목이 허가를 받았다.
에스케이케미칼(주)의 '스카이조스터주'는 국내 자체 기술로는 최초로 개발된 대상포진 백신이며, 식약처가 운영하는 '글로벌 백신 제품화 지원단'에서 맞춤형 컨설팅을 통해 국산 백신 자급화를 거둔 제품이다. 이 제품은 만 50세 이상 성인에서의 대상포진 예방을 목적으로 접종되는 백신이다.
㈜유바이오로직스의 '유비콜-플러스'는 수출용 경구용 콜레라 예방 백신이며, 동일한 효능·효과를 가진 기허가 제품을 다른 용기로 개발한 제품이다.
보툴리눔 제제의 경우, 2015년도에는 2품목, 2016년 4품목, 2017년도에는 2품목이 신규로 허가받았다.
대웅제약의 '나보타주25단위'는 동일한 효능·효과를 가진 기허가 제품을 다른 단위로 개발한 제품이며, '대웅보툴리눔톡신주100단위'는 동일한 효능·효과를 가진 기허가 제품을 수출용 품목으로 허가받은 제품이다.
혈액제제의 경우, 2016년도에 허가 받은 품목이 없었던데 비해, 2017년도에는 혈장분획제제 1품목, 혈액성분제제 1품목이 허가를 받았다.
녹십자의 글리신 첨가 사람면역글로불린 제제인 '아이비글로불린 에스엔주10%'는 기허가 제품에 비해 사람면역글로불린-지 함량을 증량하고 안정제를 변경한 제품이다.
대한적십자사남부혈액원의 '대한적십자사남부혈액원세척혈소판'은 백혈구 제거성분채혈혈소판을 이용하여 제조한 신규 혈액성분제제이다.

무단 전재·복사·배포 등을 금지합니다.



