6~7월 내 최종 임상시험결과보고서 확보 후 신속히 미국 임상 2상 진입
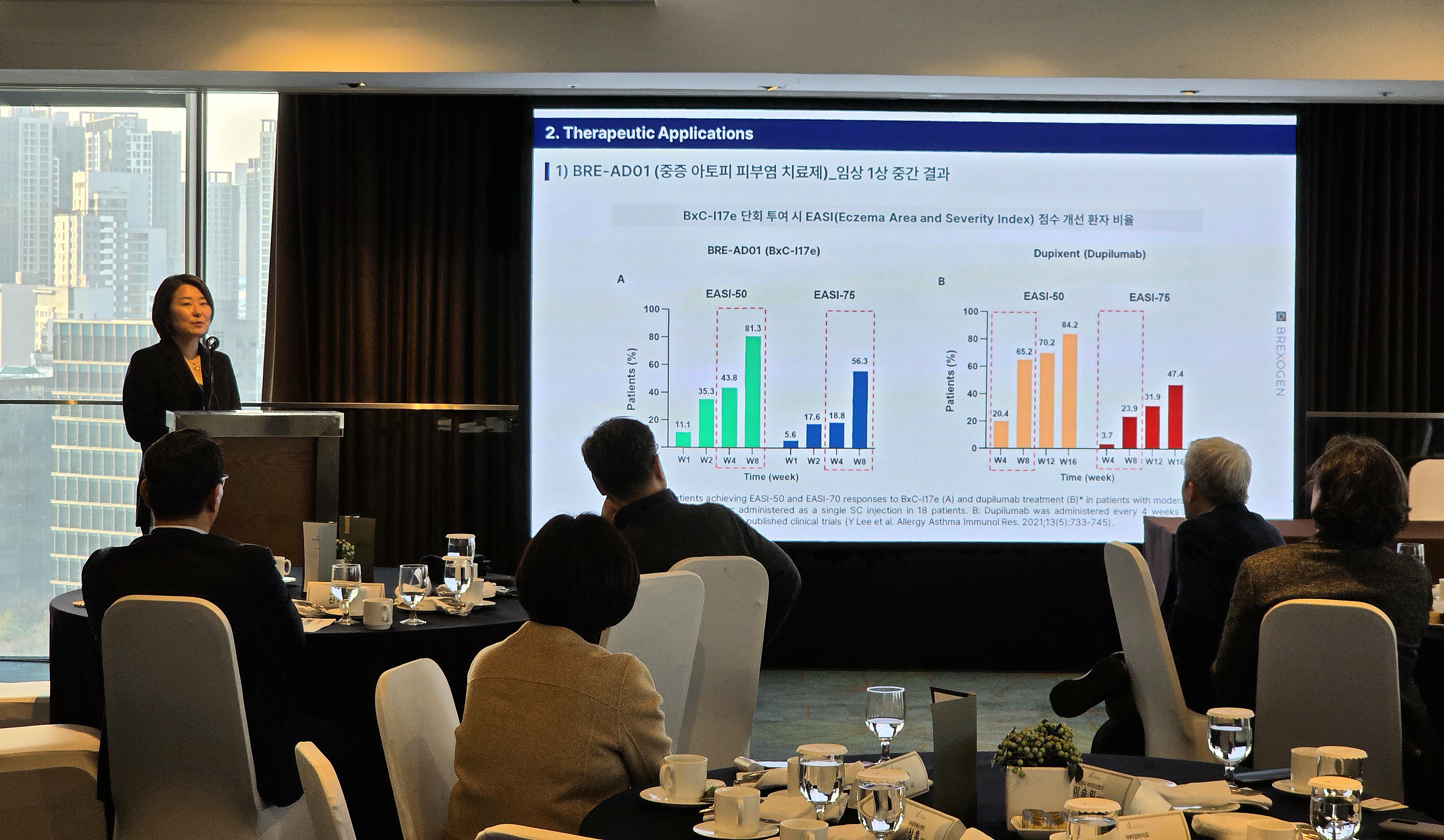
브렉소젠이 엑소좀 기반 아토피 신약후보 ‘BRE-AD01’의 미국 임상 1상 중간 결과 정량 데이터를 처음 공개했다. 단회 피하 투여 8주 만에 EASI-75 56.3%를 기록한 것이 핵심이다. 직접 비교 임상은 아니지만, 사노피의 ‘듀피젠트’ 8주 데이터 대비 높은 반응률을 보여 향후 표준 치료제와 어깨를 나란히 할 잠재력도 제기된다.
브렉소젠 김수 대표는 12일 서울 서초구 양재 엘타워에서 열린 ‘2026년도 엑소좀산업협의회 정기총회’에서 BRE-AD01의 미국 임상 1상 유효성 중간 데이터를 최초로 공개했다.
해당 임상은 미국에서 중등도~중증 아토피피부염 환자를 대상으로 단회 및 반복 투여 시 안전성, 내약성, 유효성을 평가하도록 설계됐다. 단회 투여군(Part I)은 총 27명으로 3개 코호트(코호트당 9명)로 구성됐으며, BRE-AD01과 위약을 2:1로 무작위 배정했다. 투여 용량은 회사 발표 기준 25μg, 50μg, 100μg이며, 안전성은 26주까지 추적 관찰한다.
유효성 평가는 8주까지 EASI(Eczema Area and Severity Index), IGA(Investigator’s Global Assessment), 병변 체표면적(BSA), SCORAD, Pruritus NRS, DLQI 등을 기준으로 분석했다.
EASI는 병변 면적과 홍반, 구진, 찰상, 태선화 등을 종합해 0~72점 범위로 산출하는 아토피피부염 표준 중증도 지표다. EASI-75는 기저치 대비 점수가 75% 이상 감소한 환자의 비율을 의미한다. 아토피 신약 개발에서 주요 유효성 지표 중 하나다.
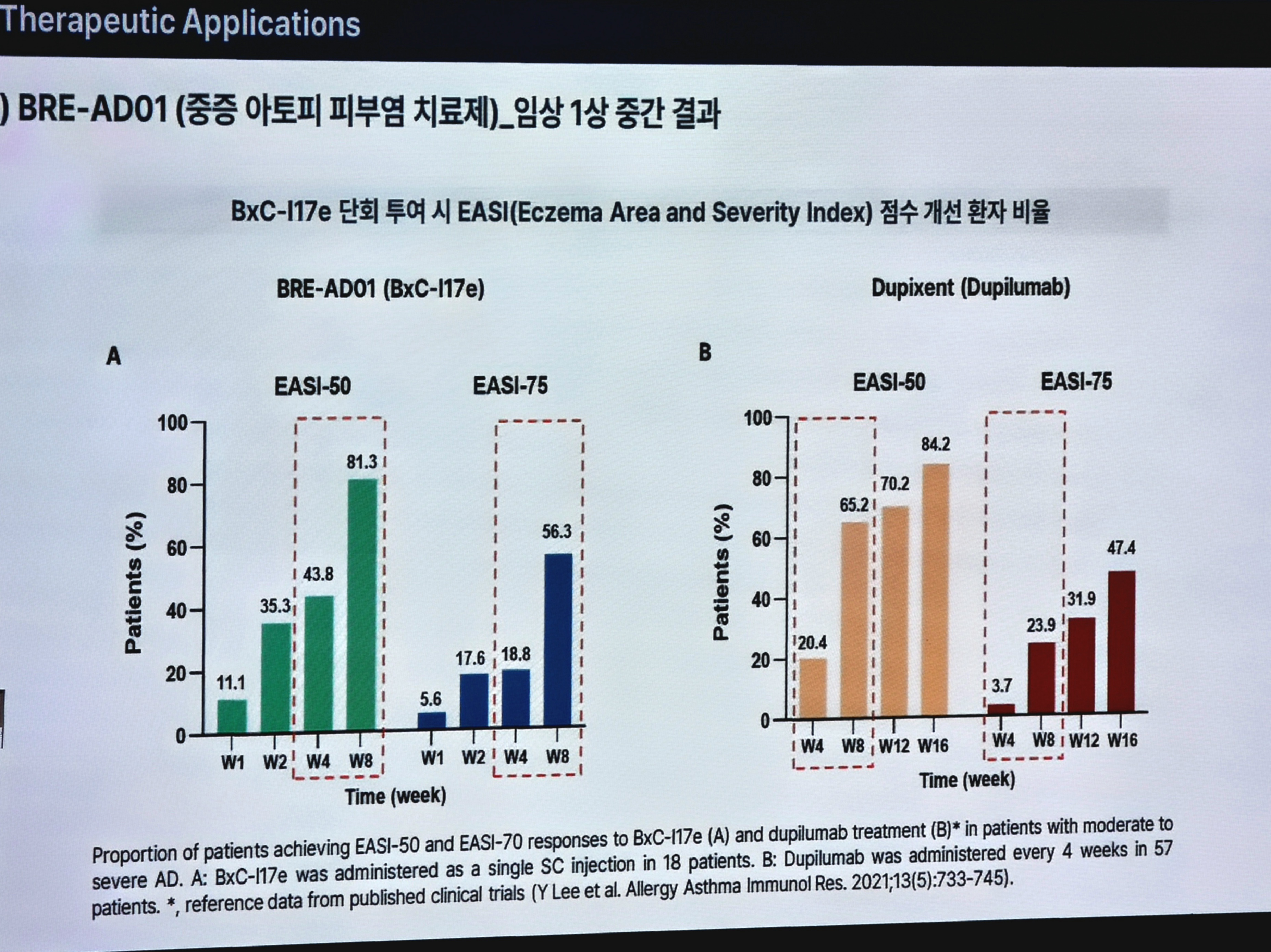
이번 중간 분석에서 BRE-AD01은 단회 투여 8주 시점 EASI-75 56.3%, EASI-50 81.3%를 기록했다. 1회 투여 후 8주까지 개선 효과가 유지된 점도 확인됐다.
듀피젠트는 과거 임상에서 4주 간격 반복 투여 시 8주 시점 EASI-75 23.9%, 16주 시점 47.4%로 보고된 바 있다. 동일 조건 head-to-head 임상이 아니므로 우월성을 단정할 수는 없으나, 그럼에도 BRE-AD01이 단 1회 투여만으로 8주 만에 EASI-75 56.3%를 기록했다는 점은 주목할 만한 결과로 평가된다.
또한 아토피 치료를 위한 다수 항체 치료제가 반복 투여를 통해 점진적인 반응을 보이는 것과 달리, BRE-AD01는 단회 투여만으로 빠르게 높은 EASI-75에 도달한 점은 시장 경쟁에서 매우 중요한 신호다.
김 대표는 “이번 1상 중간 결과는 엑소좀 기반 치료제가 아토피 임상에서 EASI와 같은 정량 지표로 유의미한 신호를 낼 수 있다는 점을 확인한 사례”라며 “특히 단회 투여 8주 만에 EASI-75 56.3%를 기록한 것은 반응 속도 측면에서 강점을 보여준 결과”라고 말했다.
듀피젠트는 IL-4/IL-13 신호를 직접 차단하는 항체 치료제로 현재 아토피 질환 글로벌 표준 치료제로 자리 잡았다. 사노피가 지난 1월 발표한 실적에 따르면, 듀피젠트 2024년 글로벌 매출은 130억7200만 유로(약 22조3000억원)에 이르는 블록버스터다. 다만 장기 유지 치료 부담, 일반 백신 동시 접종 제한, 주사 부위 및 결막염 이상반응 등은 한계로 지적됐다.
BRE-AD01은 IL-4Rα·IL-13Rα 수용체 발현 자체를 감소시키는 전략을 취한다. HSP70 단백질과 miR-223-3p를 통해 수용체 발현을 조절하고, JAK-STAT 신호 전달을 억제하는 구조다. 리간드를 차단하는 항체와 달리, 수용체 발현 조절 기반 접근이다. 전임상에서는 피부 장벽 개선 효과도 확인됐다.
현재 BRE-AD01는 반복 투여 코호트(2주 간격 4회 투여)는 추적 관찰 중이다. 회사는 오는 6~7월 내 최종 임상시험결과보고서(CSR)를 확보한 빠르게 임상 2상에 진입할 계획이다.
김 대표는 “이번 임상이 듀피젠트와 동일 조건의 직접 비교 임상이 아니기 때문에 우월성을 단정할 수는 없다”면서도 “단회 투여만으로 8주 시점에 이 정도 반응률을 보였다는 점은 향후 표준 치료제와 경쟁할 수 있는 잠재력을 보여주는 신호”라고 평가했다.
이어 그는 “BRE-AD01은 IL-4와 IL-13을 단순 차단하는 방식이 아니라, IL-4Rα와 IL-13Rα 수용체 발현 자체를 조절하는 기전적 차별성을 갖고 있다”며 “이 특성을 2상에서 보다 명확히 검증하겠다”라고 밝혔다.
한편 엑소좀산업협의회는 이날 정기총회를 통해 김수 대표를 제3대 회장으로, 랩스피너 이규상 대표를 신임 부회장으로 각각 선임했다.

| 인기기사 | 더보기 + |
-
1 툴젠, 소송·협상 전문가 구본천 최고법률책임자 영입 -
2 30년 만 국소진행성 췌장암 치료법 FDA 허가 -
3 보령, ‘카나브’ 약가 인하 소송 1심 패소 -
4 현대ADM ,췌장암 오가노이드 유전자 분석 통해 '가짜 내성' 실체 최초 입증 -
5 네오이뮨텍, R&D선택·집중 속 상업화 자산 확보로 중단기 실적 가시성 제고 -
6 아이센스,혈당관리 기업 ‘라이프스캔 ’과 CGM PL 공급 계약 체결 -
7 "제네릭 약가 40%대 일괄 인하, 신약 개발 '돈줄' 마르게 할 것" -
8 셀트리온, 약 1조 4,633억원 규모 자사주 소각 안건 주총 상정 -
9 엑소좀산업협의회 새 수장 브렉소젠 김수 대표 “엑소좀 대전환 시작” -
10 복지부-보산진, 글로벌 빅파마 6곳과 손잡고 ‘K-바이오’ 키운다
| 인터뷰 | 더보기 + |
| PEOPLE | 더보기 + |
| 컬쳐/클래시그널 | 더보기 + |

- 권혁진 기자 hjkwon@yakup.com
- 입력 2026.02.13 06:00 수정 2026.02.13 06:01

브렉소젠이 엑소좀 기반 아토피 신약후보 ‘BRE-AD01’의 미국 임상 1상 중간 결과 정량 데이터를 처음 공개했다. 단회 피하 투여 8주 만에 EASI-75 56.3%를 기록한 것이 핵심이다. 직접 비교 임상은 아니지만, 사노피의 ‘듀피젠트’ 8주 데이터 대비 높은 반응률을 보여 향후 표준 치료제와 어깨를 나란히 할 잠재력도 제기된다.
브렉소젠 김수 대표는 12일 서울 서초구 양재 엘타워에서 열린 ‘2026년도 엑소좀산업협의회 정기총회’에서 BRE-AD01의 미국 임상 1상 유효성 중간 데이터를 최초로 공개했다.
해당 임상은 미국에서 중등도~중증 아토피피부염 환자를 대상으로 단회 및 반복 투여 시 안전성, 내약성, 유효성을 평가하도록 설계됐다. 단회 투여군(Part I)은 총 27명으로 3개 코호트(코호트당 9명)로 구성됐으며, BRE-AD01과 위약을 2:1로 무작위 배정했다. 투여 용량은 회사 발표 기준 25μg, 50μg, 100μg이며, 안전성은 26주까지 추적 관찰한다.
유효성 평가는 8주까지 EASI(Eczema Area and Severity Index), IGA(Investigator’s Global Assessment), 병변 체표면적(BSA), SCORAD, Pruritus NRS, DLQI 등을 기준으로 분석했다.
EASI는 병변 면적과 홍반, 구진, 찰상, 태선화 등을 종합해 0~72점 범위로 산출하는 아토피피부염 표준 중증도 지표다. EASI-75는 기저치 대비 점수가 75% 이상 감소한 환자의 비율을 의미한다. 아토피 신약 개발에서 주요 유효성 지표 중 하나다.
이번 중간 분석에서 BRE-AD01은 단회 투여 8주 시점 EASI-75 56.3%, EASI-50 81.3%를 기록했다. 1회 투여 후 8주까지 개선 효과가 유지된 점도 확인됐다.
듀피젠트는 과거 임상에서 4주 간격 반복 투여 시 8주 시점 EASI-75 23.9%, 16주 시점 47.4%로 보고된 바 있다. 동일 조건 head-to-head 임상이 아니므로 우월성을 단정할 수는 없으나, 그럼에도 BRE-AD01이 단 1회 투여만으로 8주 만에 EASI-75 56.3%를 기록했다는 점은 주목할 만한 결과로 평가된다.
또한 아토피 치료를 위한 다수 항체 치료제가 반복 투여를 통해 점진적인 반응을 보이는 것과 달리, BRE-AD01는 단회 투여만으로 빠르게 높은 EASI-75에 도달한 점은 시장 경쟁에서 매우 중요한 신호다.
김 대표는 “이번 1상 중간 결과는 엑소좀 기반 치료제가 아토피 임상에서 EASI와 같은 정량 지표로 유의미한 신호를 낼 수 있다는 점을 확인한 사례”라며 “특히 단회 투여 8주 만에 EASI-75 56.3%를 기록한 것은 반응 속도 측면에서 강점을 보여준 결과”라고 말했다.

듀피젠트는 IL-4/IL-13 신호를 직접 차단하는 항체 치료제로 현재 아토피 질환 글로벌 표준 치료제로 자리 잡았다. 사노피가 지난 1월 발표한 실적에 따르면, 듀피젠트 2024년 글로벌 매출은 130억7200만 유로(약 22조3000억원)에 이르는 블록버스터다. 다만 장기 유지 치료 부담, 일반 백신 동시 접종 제한, 주사 부위 및 결막염 이상반응 등은 한계로 지적됐다.
BRE-AD01은 IL-4Rα·IL-13Rα 수용체 발현 자체를 감소시키는 전략을 취한다. HSP70 단백질과 miR-223-3p를 통해 수용체 발현을 조절하고, JAK-STAT 신호 전달을 억제하는 구조다. 리간드를 차단하는 항체와 달리, 수용체 발현 조절 기반 접근이다. 전임상에서는 피부 장벽 개선 효과도 확인됐다.
현재 BRE-AD01는 반복 투여 코호트(2주 간격 4회 투여)는 추적 관찰 중이다. 회사는 오는 6~7월 내 최종 임상시험결과보고서(CSR)를 확보한 빠르게 임상 2상에 진입할 계획이다.
김 대표는 “이번 임상이 듀피젠트와 동일 조건의 직접 비교 임상이 아니기 때문에 우월성을 단정할 수는 없다”면서도 “단회 투여만으로 8주 시점에 이 정도 반응률을 보였다는 점은 향후 표준 치료제와 경쟁할 수 있는 잠재력을 보여주는 신호”라고 평가했다.
이어 그는 “BRE-AD01은 IL-4와 IL-13을 단순 차단하는 방식이 아니라, IL-4Rα와 IL-13Rα 수용체 발현 자체를 조절하는 기전적 차별성을 갖고 있다”며 “이 특성을 2상에서 보다 명확히 검증하겠다”라고 밝혔다.
한편 엑소좀산업협의회는 이날 정기총회를 통해 김수 대표를 제3대 회장으로, 랩스피너 이규상 대표를 신임 부회장으로 각각 선임했다.

무단 전재·복사·배포 등을 금지합니다.



 기자가 쓴 기사 더보기
기자가 쓴 기사 더보기
