“재발·불응성 환자 대상 안전성 - 치료 효능 확인”
 기자가 쓴 기사 더보기
기자가 쓴 기사 더보기
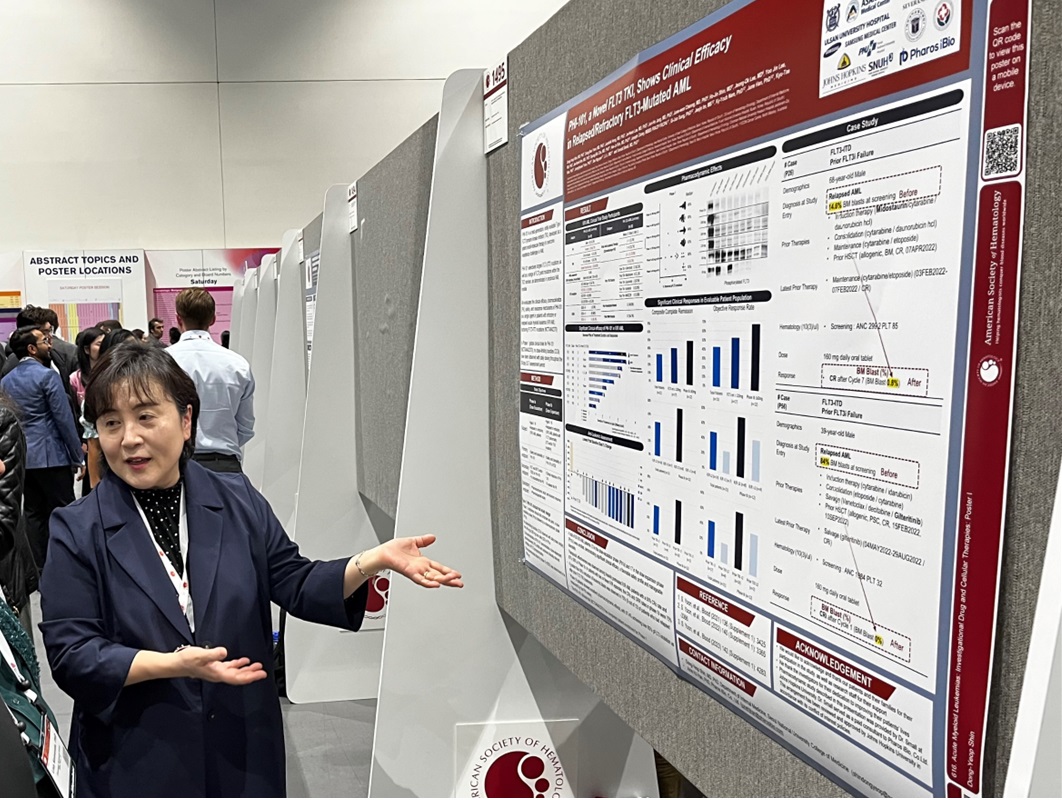
인공지능(AI) 기반 혁신 신약 개발 전문기업 파로스아이바이오(대표 윤정혁)는 미국혈액학회 연례학술대회(이하 ASH)에 참가해 급성 골수성 백혈병(AML) 치료제 ‘PHI-101’ 임상 1상의 종합적인 연구 결과를 발표했다고 9일 밝혔다.
미국혈액학회는 12월 7일(현지 시간)부터 10일까지 미국 샌디에이고에서 열리는 세계 최대 규모 혈액암 분야 학술 행사다. 파로스아이바이오는 지난해도 ASH에 참가해 PHI-101-AML 임상 1상의 중간 결과를 발표했다.
이번 임상 1상 결과에 따르면, PHI-101은 기존 승인 치료제에 내성이 생겨 불응하거나 재발한 AML 환자들에게 안전성과 내약성 및 치료 효능을 보이는 것으로 확인됐다. 이번 임상시험은 △서울대학교병원 △서울아산병원 △삼성서울병원 △부산대병원 △가톨릭대학교 서울성모병원 △호주 ICON Cancer Center 등 다수 국내외 대형병원들과 함께 재발·불응성 AML 환자 총 30명을 대상으로 진행했다.
파로스아이바이오는 지난해 완료한 임상 1a상에서 200mg까지 용량제한독성(DLT, Dose-Limiting Toxicity)이 발생하지 않고 내약성이 우수한 것을 확인했다. 임상 1b상은 올해 7월 환자 모집을 완료하고 기존 승인 치료제보다 높은 확장권장용량(RDE)인 160mg 단일요법으로 진행됐다.
1상 연구결과에 따르면, FLT3 저해제를 포함해 기존에 여러 차례 치료를 받아 중증도가 높은 고난이도의 환자가 다수 참여했음에도 평가 가능한 환자 50%가 종합완전관해(Composite Complete Response)를 보였다. 종합완전관해란 완전 관해(CR)와 불완전한 혈액학적 회복을 동반한 완전관해(CRi), 형태학적 백혈병이 없는 상태(MLFS, Morphologic Leukemia-Free State)를 포함한 수치다.
이 밖에도 PHI-101 투여를 통해 종양 크기가 줄거나 사라지는 객관적 반응률(ORR, Overall Response Rate)은 67%를 기록했다. 또 미국 존스홉킨스 의과대학 도널드 스몰 교수 연구팀과 혈장 억제 분석(PIA, Plasma Inhibitory Assay)을 진행한 결과, 임상 환자들 97%에서 급성 골수성 백혈병을 유발하는 FLT3 활성이 85% 이상 억제된 것으로 확인됐다. 파로스아이바이오는 이번 임상 시험에서 엔젠바이오와 NGS 정밀진단 기술을 활용해 임상 참여 환자 FLT3 변이 타입을 확인 및 선별했다. FLT3 변이를 보유한 급성 골수성 백혈병 환자는 그렇지 않은 환자 대비 생존율이 약 2배 낮고 재발 위험은 높다고 알려져 있다.
이번 ASH 발표자로 나선 한혜정 파로스아이바이오 최고혁신책임자(CIO) 및 미국법인 대표는 “이번 PHI-101-AML 임상 1상 성과는 기존 치료제 약효를 기대할 수 없는 AML 환자들에게 새로운 치료 옵션 가능성을 제시한 것”이라며 “2025년 글로벌 임상 2상 본격적 절차에 돌입할 예정이다. 당사가 보유한 신약 개발 역량과 노하우를 적극 활용해 기존 AML 치료제 한계를 극복한 혁신 치료제 개발에 박차를 가할 것”이라고 밝혔다.
파로스아이바이오 ‘PHI-101-AML’은 FLT3 유전자 변이를 표적해 암세포 성장을 억제하는 차세대 급성 골수성 백혈병 치료ㅈ데로 , 기존 승인된 치료제 미충족 수요를 극복하기 위해 계열 내 최고(Best-in-Class) 약물을 목표로 개발 중이다.
파로스아이바이오는 연내 PHI-101 임상 1상 시험을 성공적으로 종료하고, 내년 미국과 호주, 국내에서 임상 2상에 본격 돌입할 예정이다. 임상 2상 결과에 따라 조건부 품목 허가를 통한 조기 상용화에도 나선다. PHI-101은 식약처로부터 긴급한 급성 골수성 백혈병 환자를 대상으로 치료 목적 사용승인을 여러 차례 얻은 물질로, 미국 식품의약국(FDA) 희귀의약품 지정(ODD) 및 국내 식약처로부터 개발단계 희귀의약품으로 지정받았다.
| 인기기사 | 더보기 + |
-
1 상장 제약바이오기업 3Q 평균 매출총이익...전년비 코스피 23.6%, 코스닥 16.2%↑ -
2 아로마티카, 블랙 프라이데이 아마존 매출 급성장… 역대 최대 실적 달성 -
3 화장품 기업 80개사 3Q 영업이익 평균 95억…전년比 12.3%↑ -
4 보로노이 'VRN11', ESMO Asia서 차세대 EGFR 폐암 신약 가능성 입증 -
5 "세계 최고 학술지 네이처 열었다" 이노크라스, 암 정밀의료 새 기준 제시 -
6 미국 ‘생물보안법’ 내년 시행...전세계 의약품 공급망 파장 불가피 -
7 혈관·뼈 건강 지킴이 '고함량 초임계 비타민K2'…약사가 주목하는 이유는 -
8 로슈, 방사성 리간드 치료제 개발 파트너십 확대 -
9 제이앤피메디,나현희 부사장 영입...임상 개발 전략 역량 강화 -
10 미국 블프·사이버먼데이에도 K-뷰티 흥행, 메디큐브·바이오던스 상위권
| 인터뷰 | 더보기 + |
| PEOPLE | 더보기 + |
| 컬쳐/클래시그널 | 더보기 + |

- 이권구 기자 kwon9@yakup.com
- 입력 2024.12.09 08:53 수정 2024.12.09 08:55

인공지능(AI) 기반 혁신 신약 개발 전문기업 파로스아이바이오(대표 윤정혁)는 미국혈액학회 연례학술대회(이하 ASH)에 참가해 급성 골수성 백혈병(AML) 치료제 ‘PHI-101’ 임상 1상의 종합적인 연구 결과를 발표했다고 9일 밝혔다.
미국혈액학회는 12월 7일(현지 시간)부터 10일까지 미국 샌디에이고에서 열리는 세계 최대 규모 혈액암 분야 학술 행사다. 파로스아이바이오는 지난해도 ASH에 참가해 PHI-101-AML 임상 1상의 중간 결과를 발표했다.
이번 임상 1상 결과에 따르면, PHI-101은 기존 승인 치료제에 내성이 생겨 불응하거나 재발한 AML 환자들에게 안전성과 내약성 및 치료 효능을 보이는 것으로 확인됐다. 이번 임상시험은 △서울대학교병원 △서울아산병원 △삼성서울병원 △부산대병원 △가톨릭대학교 서울성모병원 △호주 ICON Cancer Center 등 다수 국내외 대형병원들과 함께 재발·불응성 AML 환자 총 30명을 대상으로 진행했다.
파로스아이바이오는 지난해 완료한 임상 1a상에서 200mg까지 용량제한독성(DLT, Dose-Limiting Toxicity)이 발생하지 않고 내약성이 우수한 것을 확인했다. 임상 1b상은 올해 7월 환자 모집을 완료하고 기존 승인 치료제보다 높은 확장권장용량(RDE)인 160mg 단일요법으로 진행됐다.
1상 연구결과에 따르면, FLT3 저해제를 포함해 기존에 여러 차례 치료를 받아 중증도가 높은 고난이도의 환자가 다수 참여했음에도 평가 가능한 환자 50%가 종합완전관해(Composite Complete Response)를 보였다. 종합완전관해란 완전 관해(CR)와 불완전한 혈액학적 회복을 동반한 완전관해(CRi), 형태학적 백혈병이 없는 상태(MLFS, Morphologic Leukemia-Free State)를 포함한 수치다.
이 밖에도 PHI-101 투여를 통해 종양 크기가 줄거나 사라지는 객관적 반응률(ORR, Overall Response Rate)은 67%를 기록했다. 또 미국 존스홉킨스 의과대학 도널드 스몰 교수 연구팀과 혈장 억제 분석(PIA, Plasma Inhibitory Assay)을 진행한 결과, 임상 환자들 97%에서 급성 골수성 백혈병을 유발하는 FLT3 활성이 85% 이상 억제된 것으로 확인됐다. 파로스아이바이오는 이번 임상 시험에서 엔젠바이오와 NGS 정밀진단 기술을 활용해 임상 참여 환자 FLT3 변이 타입을 확인 및 선별했다. FLT3 변이를 보유한 급성 골수성 백혈병 환자는 그렇지 않은 환자 대비 생존율이 약 2배 낮고 재발 위험은 높다고 알려져 있다.
이번 ASH 발표자로 나선 한혜정 파로스아이바이오 최고혁신책임자(CIO) 및 미국법인 대표는 “이번 PHI-101-AML 임상 1상 성과는 기존 치료제 약효를 기대할 수 없는 AML 환자들에게 새로운 치료 옵션 가능성을 제시한 것”이라며 “2025년 글로벌 임상 2상 본격적 절차에 돌입할 예정이다. 당사가 보유한 신약 개발 역량과 노하우를 적극 활용해 기존 AML 치료제 한계를 극복한 혁신 치료제 개발에 박차를 가할 것”이라고 밝혔다.
파로스아이바이오 ‘PHI-101-AML’은 FLT3 유전자 변이를 표적해 암세포 성장을 억제하는 차세대 급성 골수성 백혈병 치료ㅈ데로 , 기존 승인된 치료제 미충족 수요를 극복하기 위해 계열 내 최고(Best-in-Class) 약물을 목표로 개발 중이다.
파로스아이바이오는 연내 PHI-101 임상 1상 시험을 성공적으로 종료하고, 내년 미국과 호주, 국내에서 임상 2상에 본격 돌입할 예정이다. 임상 2상 결과에 따라 조건부 품목 허가를 통한 조기 상용화에도 나선다. PHI-101은 식약처로부터 긴급한 급성 골수성 백혈병 환자를 대상으로 치료 목적 사용승인을 여러 차례 얻은 물질로, 미국 식품의약국(FDA) 희귀의약품 지정(ODD) 및 국내 식약처로부터 개발단계 희귀의약품으로 지정받았다.
무단 전재·복사·배포 등을 금지합니다.



