앱클론, 위암 표적치료제 'AC101' 임상 2상서 효능 확인
中 상하이 헨리우스 바이오텍, AC101 기술이전 받아 임상 2상 진행…중간 결과 발표
입력 2022.09.16 17:31
수정 2022.09.16 17:32
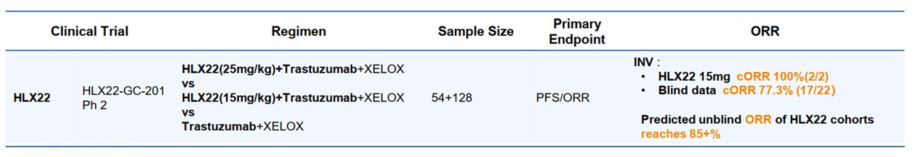
▲상하이 헨리우스 바이오텍 2022년 상반기 투자자 보고서 발췌(자료=앱클론)
앱클론이 상하이 헨리우스 바이오텍(이하 헨리우스)에 기술이전(L/O)한 위암 표적 치료제 AC101의 임상2상 중간 결과가 헨리우스의 투자자 반기보고서를 통해 공개됐다고 밝혔다.
헨리우스는 AC101(헨리우스의 코드명: HLX22)을 HER2 양성 진행성/전이성 위암 1차 치료제로 개발하고 있다.
헨리우스에 따르면, AC101과 허셉틴 바이오시밀러 및 화학요법의 병용 투여 임상에서 AC101 저용량(15mg/kg) 및 고용량(25mg/kg) 투여군의 객관적 반응률(ORR)이 85% 이상이라는 예측 결과가 도출됐다.
현재 허가된 HER2 양성 진행성/전이성 위암 1차 치료 요법 중 ‘면역관문억제제 키트루다(Pembrolizumab)와 허셉틴 및 화학요법 병용 투여’에서 ORR이 74.4%로 가장 높게 나타나는데, AC101이 이보다 높은 ORR을 보일 것으로 예측돼 ‘베스트 인 클래스(Best-in-class)’에 대한 기대감을 높였다.
AC101은 앱클론의 독자적 항체 신약 개발 플랫폼 ‘NEST(Novel Epitope Screening Technology)’를 통해 개발됐다. NEST는 질환 단백질의 새로운 에피토프에 결합하는 항체를 발굴하는 기술이다.
앱클론은 AC101을 위암 및 유방암 치료제로 개발했으며, 2016년 글로벌 파트너사인 중국 최대 제약 그룹 복성 제약의 헨리우스에 기술이전했다. 헨리우스는 2019년 중국에서 임상1상을 시작해 2021년 임상2상에 착수했으며, 이번 투자자 반기보고서를 통해 글로벌 임상 계획도 발표했다.
앱클론 관계자는 “AC101의 임상2상 중간 결과를 통해 현존하는 기존 치료제 대비 탁월한 효능 지표를 확인했으며, 베스트 인 클래스 위암 치료제 개발 가능성을 높였다”면서 “해당 치료제의 임상2상∙3상 완료 및 허가에 따른 마일스톤과 출시 후 로열티 등 회사의 추가 수익도 기대된다”고 말했다.
한편, 시장조사 기관 델브인사이트(DelveInsight)의 2021년 10월 보고서에 의하면, 유럽 주요 5개국을 비롯해 미국, 일본, 중국, 한국 등 주요 HER2 양성 위암 치료제 시장은 1.1조 달러 규모를 형성하고 있으며, 2030년까지 3.11%의 연평균 성장률(CAGR)을 기록할 것으로 전망된다.
[관련기사]
유틸렉스·앱클론 등 8월 한달간 주가 급등
2022-09-13 06:00
앱클론, 혁신 카티 세포치료제 기술 미국 및 캐나다 특허 등록
2022-09-05 10:56
HK이노엔-지아이셀, CAR-NK세포치료제 공동연구개발
2022-08-29 10:45
앱클론, 유펜 의대와 혁신 CAR-T 치료제 공동연구 확대
2022-07-29 11:07
앱클론, 220억원 투자 유치…CAR-T 개발 가속화
2022-07-27 10:15
앱클론 "혁신 CAR-T 세포치료제 日 특허 등록 완료"
2022-06-03 16:37
앱클론, CAR-T 신약치료제 임상 첫 환자 투여 개시…임상 본격화
2022-05-19 22:30
오늘의 헤드라인
전체댓글 0개
등록된 댓글이 없습니다.
| 인기기사 | 더보기 + |
-
1 국회서 제동 걸린 '제네릭 약가 인하’… 장관도 "기준점 재검토" 시사 -
2 중국 빠진 미국, 삼성바이오로직스가 차지하나…미주 매출만 1조7339억원 -
3 뷰티 기업 '엑시트' 관문 좁아져…투자·인수 '선별' 강화 -
4 안국약품, 작년 매출 3000억 돌파... '7% 고배당'·'미용·바이오 신사업' 눈길 -
5 약업대상 수상 김대업 "약사사회, 국민 이익과 만나는 정책 가야" -
6 제약바이오 CGT 족쇄 푼다… DIA, 글로벌 규제 당국과 해법 찾기 -
7 HIV 치료 단순화 흐름 본격화 -
8 한미약품 ‘아모프렐’ 3상 임상 결과, 미국심장학회 공식 저널 JACC 등재 -
9 국가암검진에 ‘대장내시경’ 전면 도입…내시경 산업 성장 점화 기대 -
10 카나프 이병철 대표 “임상·기술이전 매년 1건…지속가능 신약개발 체계 완성”
| 인터뷰 | 더보기 + |
| PEOPLE | 더보기 + |
| 컬쳐/클래시그널 | 더보기 + |

앱클론, 위암 표적치료제 'AC101' 임상 2상서 효능 확인
中 상하이 헨리우스 바이오텍, AC101 기술이전 받아 임상 2상 진행…중간 결과 발표
- 권혁진 기자 hjkwon@yakup.com
- 입력 2022.09.16 17:31 수정 2022.09.16 17:32

▲상하이 헨리우스 바이오텍 2022년 상반기 투자자 보고서 발췌(자료=앱클론)
앱클론이 상하이 헨리우스 바이오텍(이하 헨리우스)에 기술이전(L/O)한 위암 표적 치료제 AC101의 임상2상 중간 결과가 헨리우스의 투자자 반기보고서를 통해 공개됐다고 밝혔다.
헨리우스는 AC101(헨리우스의 코드명: HLX22)을 HER2 양성 진행성/전이성 위암 1차 치료제로 개발하고 있다.
헨리우스에 따르면, AC101과 허셉틴 바이오시밀러 및 화학요법의 병용 투여 임상에서 AC101 저용량(15mg/kg) 및 고용량(25mg/kg) 투여군의 객관적 반응률(ORR)이 85% 이상이라는 예측 결과가 도출됐다.
현재 허가된 HER2 양성 진행성/전이성 위암 1차 치료 요법 중 ‘면역관문억제제 키트루다(Pembrolizumab)와 허셉틴 및 화학요법 병용 투여’에서 ORR이 74.4%로 가장 높게 나타나는데, AC101이 이보다 높은 ORR을 보일 것으로 예측돼 ‘베스트 인 클래스(Best-in-class)’에 대한 기대감을 높였다.
AC101은 앱클론의 독자적 항체 신약 개발 플랫폼 ‘NEST(Novel Epitope Screening Technology)’를 통해 개발됐다. NEST는 질환 단백질의 새로운 에피토프에 결합하는 항체를 발굴하는 기술이다.
앱클론은 AC101을 위암 및 유방암 치료제로 개발했으며, 2016년 글로벌 파트너사인 중국 최대 제약 그룹 복성 제약의 헨리우스에 기술이전했다. 헨리우스는 2019년 중국에서 임상1상을 시작해 2021년 임상2상에 착수했으며, 이번 투자자 반기보고서를 통해 글로벌 임상 계획도 발표했다.
앱클론 관계자는 “AC101의 임상2상 중간 결과를 통해 현존하는 기존 치료제 대비 탁월한 효능 지표를 확인했으며, 베스트 인 클래스 위암 치료제 개발 가능성을 높였다”면서 “해당 치료제의 임상2상∙3상 완료 및 허가에 따른 마일스톤과 출시 후 로열티 등 회사의 추가 수익도 기대된다”고 말했다.
한편, 시장조사 기관 델브인사이트(DelveInsight)의 2021년 10월 보고서에 의하면, 유럽 주요 5개국을 비롯해 미국, 일본, 중국, 한국 등 주요 HER2 양성 위암 치료제 시장은 1.1조 달러 규모를 형성하고 있으며, 2030년까지 3.11%의 연평균 성장률(CAGR)을 기록할 것으로 전망된다.
Copyright © Yakup.com All rights reserved.
약업신문 의 모든 컨텐츠(기사)는 저작권법의 보호를 받습니다.
무단 전재·복사·배포 등을 금지합니다.
무단 전재·복사·배포 등을 금지합니다.



 기자가 쓴 기사 더보기
기자가 쓴 기사 더보기
