 기자가 쓴 기사 더보기
기자가 쓴 기사 더보기
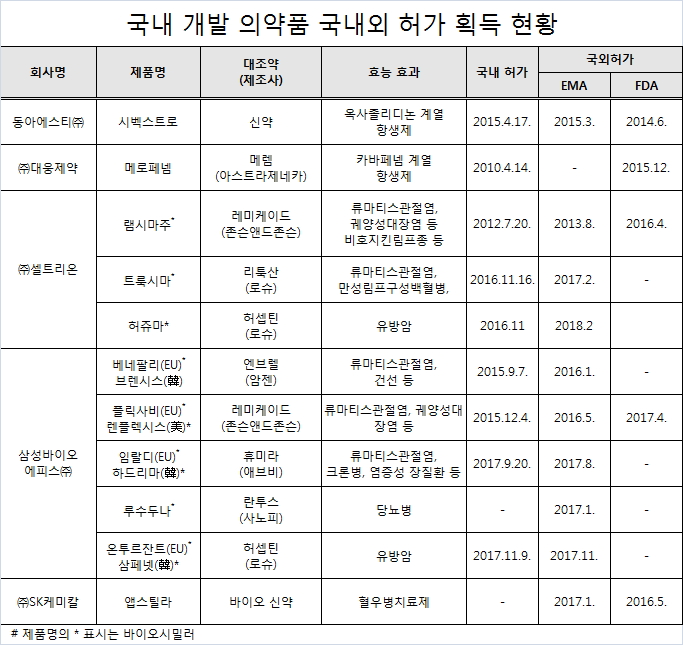
지난 2013년 이후 국내 제약사들이 개발한 의약품 11개가 미국과 EU의 인허가 장벽을 뚫고 판매가 본격화된 것으로 나타났다.
보건복지부에 따르면 지난 2013년 8월 셀트리온의 램시마주가 유럽의약품청(European Medicines Agency, EMA)의 허가를 받은 것을 시작으로 2017년 11월 삼성바이오에피스의 '온투르잔트' , 2018년 2월 셀트리온의 '허쥬마'' 등 국내개발 의약품 11품목이 미국과 EU의 인허가 획득하고 선진국 시장에서 판매가 되고 있는 것으로 집계됐다.
회사별로는 삼성바이오에피스가 베네팔리·플릭사비·임랄디·루수두나·온투르잔트 등 5품목으로 가장 많았고, 셀트리온이 램시마주·트룩시마·허쥬마 등 3품목이었다.
동아에스티 '시벡스트로', 대웅제약 '메로페넴', SK케미칼 '앱스틸라'도 미국과 유럽에서 인허가를 획득했다.
미국과 유럽에서 인허가를 획득한 11품목중 동아에스티 '시벡스트로', 대웅제약 '메로페넴' SK케미칼 '앱스틸라' 등 3품목을 제외한 나머지 8품목은 바이오시밀러였다. 이는 자체 개발한 신약보다 바이오시밀러가 글로벌 경쟁력이 높다는 것을 의미하는 것이다.
또 동아에스티의 '시벡스트로'. 셀트리온의 '램시마주', 삼성바이오에피스의 '플릭사비', SK케미칼의 '엡스틸라' 등 미국 FDA와 EU EMA의 허가를 받은 품목으로 조사됐다.
| 인기기사 | 더보기 + |
-
1 알지노믹스, 일반청약 경쟁률 1871대 1…"증거금 10조8425억원" -
2 내년부터 AI 화장품 이미지·영상에 'AI 생성물' 표시 의무화 -
3 화장품 기업 80개사 3Q 누적 타사상품 유통매출 평균 314억…전년比 3.8%↓ -
4 뉴베카·테빔브라 급여 첫 관문 통과…전립선암·폐암 치료제 선택지 확대 -
5 약가 인하의 불편한 진실㊤ “제네릭 붕괴는 곧 신약 생태계 붕괴” -
6 엔케이맥스,상장폐지 관련 이의신청서 거래소 제출 -
7 “신약개발 죽음의 계곡, 집단지성으로 돌파” 독성전문가와 의약개발자의 '전략적 동맹' -
8 대웅 '거점도매 선정'에 유통업계 반발 "상생 무너진 구조 재검토해야" -
9 한국비엠아이 "2030년 매출 5천억 돌파, 2035년까지 1조 목표" -
10 인벤티지랩, 남성형 탈모 치료제 ‘IVL3001’ 글로벌 임상 2상 IND 신청
| 인터뷰 | 더보기 + |
| PEOPLE | 더보기 + |
| 컬쳐/클래시그널 | 더보기 + |

- 김용주 기자 yjkim@yakup.com
- 입력 2018.03.07 06:20 수정 2018.03.07 09:09

지난 2013년 이후 국내 제약사들이 개발한 의약품 11개가 미국과 EU의 인허가 장벽을 뚫고 판매가 본격화된 것으로 나타났다.
보건복지부에 따르면 지난 2013년 8월 셀트리온의 램시마주가 유럽의약품청(European Medicines Agency, EMA)의 허가를 받은 것을 시작으로 2017년 11월 삼성바이오에피스의 '온투르잔트' , 2018년 2월 셀트리온의 '허쥬마'' 등 국내개발 의약품 11품목이 미국과 EU의 인허가 획득하고 선진국 시장에서 판매가 되고 있는 것으로 집계됐다.
회사별로는 삼성바이오에피스가 베네팔리·플릭사비·임랄디·루수두나·온투르잔트 등 5품목으로 가장 많았고, 셀트리온이 램시마주·트룩시마·허쥬마 등 3품목이었다.
동아에스티 '시벡스트로', 대웅제약 '메로페넴', SK케미칼 '앱스틸라'도 미국과 유럽에서 인허가를 획득했다.
미국과 유럽에서 인허가를 획득한 11품목중 동아에스티 '시벡스트로', 대웅제약 '메로페넴' SK케미칼 '앱스틸라' 등 3품목을 제외한 나머지 8품목은 바이오시밀러였다. 이는 자체 개발한 신약보다 바이오시밀러가 글로벌 경쟁력이 높다는 것을 의미하는 것이다.
또 동아에스티의 '시벡스트로'. 셀트리온의 '램시마주', 삼성바이오에피스의 '플릭사비', SK케미칼의 '엡스틸라' 등 미국 FDA와 EU EMA의 허가를 받은 품목으로 조사됐다.
무단 전재·복사·배포 등을 금지합니다.



