미국 59%, 중국 35% 등 글로벌 신약 시장 ‘우선심사’ 활용 보편화
한국바이오의약품협회(KoBIA, 회장 이정석)는 미국, 유럽, 일본, 중국, 한국의 의약품 신속심사 제도 현황을 분석한 ‘주요국의 의약품 신속심사 제도’ 보고서를 발간했다고 22일 밝혔다.
미국 FDA, 미충족 수요 해결 위해 CNPV·RDEP 등 신규 제도 시범 운영 및 논의
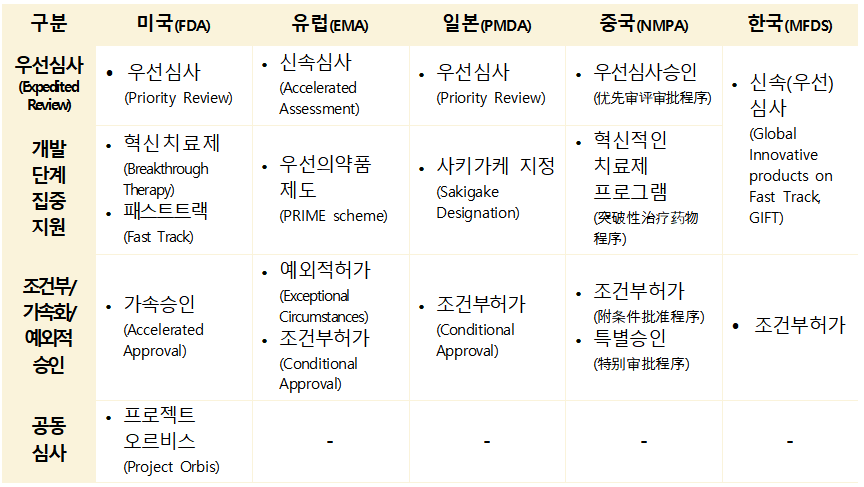
미국은 기존의 우선심사(Priority Review), 혁신치료제(Breakthrough Therapy) 지정 외에도 더욱 세분화된 신속심사 제도를 도입하며 규제 유연성을 극대화하고 있다.
국가 우선 바우처(CNPV) 시범 프로그램 (2025년): 미국의 공중 보건 위기 해결이나 공급망 회복력 강화를 위한 의약품을 대상으로 하며, 완전한 신청서 검토 시간을 1~2개월까지 단축할 수 있는 혜택을 제공한다.
희귀질환 근거 원칙(RDEP) (2025년 9월 도입): 1,000명 미만의 극희귀 질환 치료제 개발 시, 소규모 환자 집단의 특성을 고려하여 유연한 근거 자료를 인정해 주는 절차다.
타당한 기전 경로(Plausible Mechanism Pathway) (2025년 11월 신설): 치료제의 질병 표적 가능성에 대한 합리적인 기전적 근거가 확보되면 허가를 검토하는 경로로, 도입된다면 맞춤형 치료제의 시장 진입을 더욱 앞당길 것으로 전망된다.
미국 신약 승인 중 59%는 미국 ‘우선심사’ 통해 시장 진입
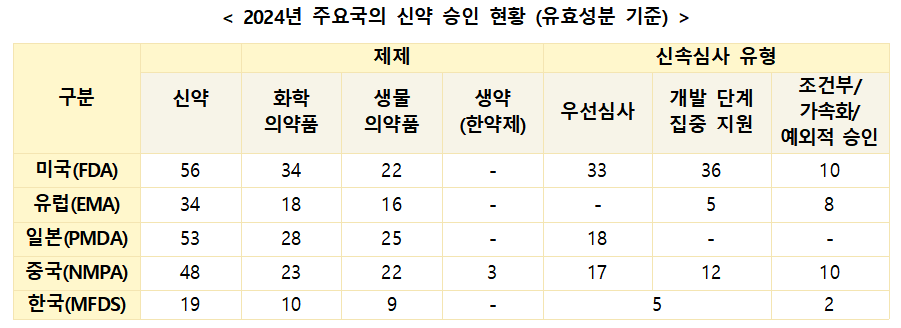
2024년 신약 승인 시 ‘우선심사’ 활용 비율이 가장 높았던 국가는 미국으로 나타났다. 미국의 우선심사(Priority Review) 활용률은 59%에 달하며, 중국(35%), 일본(34%)이 그 뒤를 이었다.
특히 미국은 ‘개발 단계 집중 지원’(Breakthrough Therapy, Fast Track) 항목에서도 64%의 높은 활용률을 기록했다. 신속심사 경로를 활용한 신약은 평균 심사 기간이 6~9개월로, 표준심사(10~12개월) 대비 최대 6개월까지 단축되는 효과를 보였다.
한국의 경우, 2024년 승인된 신약 19건 중 5건이 GIFT 허가심사를 통해 승인되었다. 2025년 9월까지의 통계에 따르면, GIFT 품목의 평균 심사 소요 기간은 70일(근무일 기준)로, 법정 처리 기한 대비 약 25%의 기간 단축 성과를 거두며 국내 신약의 신속한 시장 진입을 지원하고 있다.
“개발 초기부터 전략적 규제 협력 필수… 국내 허가 프로세스 개선 활용”
협회는 국내 기업이 해외 진출 시 의약품 개발 초기 단계(임상 1·2상)부터 FDA, EMA, PMDA 등 현지 규제 당국과 사전 협의를 통해 신속심사 적격성을 타진해야 한다고 강조했다.
또한, 식약처가 2025년 12월 바이오의약품허가과를 정규조직으로 전환하고 심사 인력을 확충하는 등 허가 프로세스 개선을 추진하고 있는 만큼, 기업들은 정부의 밀착 지원을 활용하여 시장 진입 기간 단축을 도모할 필요가 있다고 언급했다.
해당 보고서는 협회 홈페이지(www.kobia.kr)에서 다운로드 할 수 있다.
| 인기기사 | 더보기 + |
-
1 상장 제약바이오 2025년 3Q 평균 이자비용 · 이자보상배율…전년비 '증가' -
2 USP "GLP-1 비만치료제, 전쟁 승부처는 불순물(impurity)과 품질(quality)" -
3 올해 첫 암질심, 예스카타 '부분 통과'…리브리반트는 전면 미설정 -
4 조관구 지씨씨엘 대표 "바이오 투자 양극화 심화… 플랫폼 기술이 돌파구" -
5 정맥에서 피하로…GSK, 젬펄리 제형 전략 가속 -
6 한미약품,월 1회 투약 당뇨치료제 'HM11260C' 임상3상 IND 승인 -
7 종근당,지난해 4Q 건기식 소비자 관심도 1위…유한양행·동국제약 순 -
8 서울시의약품유통협회, '상생 연대'로 업권 수호 선언 -
9 [2026 R&D⑧]산업통상부, 제약바이오 ‘제조 강국’으로 반도체 신화 정조준 -
10 BMSㆍ마이크로소프트, 폐암 조기진단 취지 제휴
| 인터뷰 | 더보기 + |
| PEOPLE | 더보기 + |
| 컬쳐/클래시그널 | 더보기 + |

- 권혁진 기자 hjkwon@yakup.com
- 입력 2026.01.22 10:31

한국바이오의약품협회(KoBIA, 회장 이정석)는 미국, 유럽, 일본, 중국, 한국의 의약품 신속심사 제도 현황을 분석한 ‘주요국의 의약품 신속심사 제도’ 보고서를 발간했다고 22일 밝혔다.
미국 FDA, 미충족 수요 해결 위해 CNPV·RDEP 등 신규 제도 시범 운영 및 논의
미국은 기존의 우선심사(Priority Review), 혁신치료제(Breakthrough Therapy) 지정 외에도 더욱 세분화된 신속심사 제도를 도입하며 규제 유연성을 극대화하고 있다.
국가 우선 바우처(CNPV) 시범 프로그램 (2025년): 미국의 공중 보건 위기 해결이나 공급망 회복력 강화를 위한 의약품을 대상으로 하며, 완전한 신청서 검토 시간을 1~2개월까지 단축할 수 있는 혜택을 제공한다.
희귀질환 근거 원칙(RDEP) (2025년 9월 도입): 1,000명 미만의 극희귀 질환 치료제 개발 시, 소규모 환자 집단의 특성을 고려하여 유연한 근거 자료를 인정해 주는 절차다.
타당한 기전 경로(Plausible Mechanism Pathway) (2025년 11월 신설): 치료제의 질병 표적 가능성에 대한 합리적인 기전적 근거가 확보되면 허가를 검토하는 경로로, 도입된다면 맞춤형 치료제의 시장 진입을 더욱 앞당길 것으로 전망된다.
미국 신약 승인 중 59%는 미국 ‘우선심사’ 통해 시장 진입
2024년 신약 승인 시 ‘우선심사’ 활용 비율이 가장 높았던 국가는 미국으로 나타났다. 미국의 우선심사(Priority Review) 활용률은 59%에 달하며, 중국(35%), 일본(34%)이 그 뒤를 이었다.
특히 미국은 ‘개발 단계 집중 지원’(Breakthrough Therapy, Fast Track) 항목에서도 64%의 높은 활용률을 기록했다. 신속심사 경로를 활용한 신약은 평균 심사 기간이 6~9개월로, 표준심사(10~12개월) 대비 최대 6개월까지 단축되는 효과를 보였다.
한국의 경우, 2024년 승인된 신약 19건 중 5건이 GIFT 허가심사를 통해 승인되었다. 2025년 9월까지의 통계에 따르면, GIFT 품목의 평균 심사 소요 기간은 70일(근무일 기준)로, 법정 처리 기한 대비 약 25%의 기간 단축 성과를 거두며 국내 신약의 신속한 시장 진입을 지원하고 있다.

“개발 초기부터 전략적 규제 협력 필수… 국내 허가 프로세스 개선 활용”
협회는 국내 기업이 해외 진출 시 의약품 개발 초기 단계(임상 1·2상)부터 FDA, EMA, PMDA 등 현지 규제 당국과 사전 협의를 통해 신속심사 적격성을 타진해야 한다고 강조했다.
또한, 식약처가 2025년 12월 바이오의약품허가과를 정규조직으로 전환하고 심사 인력을 확충하는 등 허가 프로세스 개선을 추진하고 있는 만큼, 기업들은 정부의 밀착 지원을 활용하여 시장 진입 기간 단축을 도모할 필요가 있다고 언급했다.
해당 보고서는 협회 홈페이지(www.kobia.kr)에서 다운로드 할 수 있다.
무단 전재·복사·배포 등을 금지합니다.



 기자가 쓴 기사 더보기
기자가 쓴 기사 더보기
