개요
파킨슨병(Parkinson’s disease, PD)은 1817년 영국 의사 제임스 파킨슨(James Parkinson)이 ‘An Essay on the Shaking Palsy’에서 처음으로 정의한 질환으로, 이후 신경학적 연구가 발전하면서 기저핵 도파민 신경세포의 퇴행성 변화가 주된 병리 기전임이 밝혀졌다. 전 세계적으로 파킨슨병은 알츠하이머병에 이어 두 번째로 흔한 신경퇴행성 질환이며, 고령화 사회로 접어들수록 그 유병률은 급격히 증가하고 있다. 전 세계 파킨슨병의 추정 유병률은 1990년 약 250만 명에서 2016년 약 610만 명으로 두 배 이상 증가하였으며, 최근에는 2040년경 약 1,200만 명 이상으로 늘어날 것으로 전망된다.
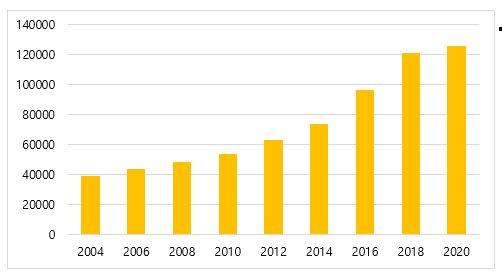
국내 연구에서도 파킨슨병 유병률은 지속적으로 증가하고 있으며, 국민건강보험 데이터를 활용한 분석에 따르면 2004년 파킨슨병 유병률은 3만9,265명에서 2019년 12만5607명으로 3.2배 증가하였다 (그림 1). 최근 유병률 증가의 원인으로는 고령 인구의 급격한 증가, 질환 인식 향상 및 진단 기술 발달, 환경적 요인(농약, 중금속, 대기오염 등)과 생활습관 변화, 생존율 향상에 따른 장기 생존 환자 증가 등이 복합적으로 작용하는 것으로 생각된다.
파킨슨병의 대표적인 운동증상(cardinal motor features)은 서동(bradykinesia), 안정시 진전(resting tremor), 근강직(rigidity), 자세 불안정(postural instability)이며, 이 중 서동은 반드시 존재해야 진단할 수 있는 핵심 증상이다. 이러한 운동증상은 도파민성 신경세포의 소실에 따른 기저핵-피질 회로(basal ganglia-cortical circuit)의 이상으로 설명된다. 병의 후기에는 약 효과가 좋을 때 (ON)과 약 효과가 없을 때 (OFF)의 차이가 나타나는 운동동요와 레보도파 유발 이상운동증이 발생할 수 있다.
한편, 비운동증상(non-motor symptoms)은 운동증상 못지않게 환자의 삶의 질에 심각한 영향을 미치며, 때로는 운동증상보다 먼저 발현하기도 한다 (그림 2). 대표적으로 렘수면행동장애(REM sleep behavior disorder, RBD)는 파킨슨병 발병 수년전에 증상이 나타난다. 장기 추적 연구에 따르면, 특발성 렘수면 행동장애 환자에서 증상 시작 후 5년에는 약 17%, 10년에는 약 40%, 12년에는 약 52%에서 파킨슨병, 루이소체 치매 등 신경퇴행성 질환이 발병하는 것으로 보고되었다. 모든 렘수면 행동장애 환자가 신경퇴행성 질환으로 진행하는 것은 아니지만, 건강 대조군에 비해 발병 위험도가 높기 때문에 주기적인 추적관찰이 필요하다.
그 외에 나타나는 비운동 증상으로는 자율신경계 증상(기립성 저혈압, 변비, 발한 이상), 후각 저하(hyposmia), 인지기능 저하 및 치매, 우울, 불안 등 정신과적 증상이 있다. 파킨슨병의 비운동증상은 단순한 동반 증상을 넘어 환자의 삶의 질을 저하시키는 주요 요인이다. 실제로 여러 연구에서, 파킨슨병 환자의 삶의 질 저하와 돌봄 부담에 미치는 영향은 운동증상보다 비운동증상이 더 크다고 보고된 바 있다. 예를 들어, 자율신경계 이상(기립성 저혈압, 변비, 발한 이상)은 일상생활에 직접적 불편을 초래할 뿐만 아니라 낙상 위험, 영양 불균형, 탈수와 같은 2차적 합병증으로 이어질 수 있다.
또한, 인지기능 저하와 치매는 환자의 독립적인 생활을 불가능하게 만들며, 장기적인 사회·경제적 비용을 크게 증가시킨다. 우울, 불안, 무관심(apathy) 등 정신과적 증상은 환자의 사회적 고립을 심화시키고 치료 순응도를 저하시키는 요인이 된다. 따라서 파킨슨병 관리에 있어 비운동증상은 단순한 부가적 증상이 아니라, 조기 진단, 다학제적 치료 접근, 지속적 모니터링이 필요한 핵심 영역이라 할 수 있다.

운동 증상은 임상적으로 가장 먼저 관찰되는 특징이 있으며, 다양한 비운동증상은 눈에 잘 띄지 않지만, 환자의 삶의 질에 큰 영향을 미친다.
파킨슨병의 핵심 병리는 흑질 치밀부 도파민 신경세포의 점진적 소실과 알파-시누클레인 단백질의 응집이다. 알파-시누클레인 단백질 응집으로 인한 세포질 내 루이소체(Lewy bodies)와 루이신경섬유(Lewy neurites)가 대표적 병리 소견이며, 이에 따른 선조체 도파민 고갈이 운동증상의 기초가 된다. 병변의 공간적 확산은 흔히 Braak 단계로 설명되는데, 후각망울, 미주신경 등 말초, 뇌간 구조에서 시작해 청반, 흑색질을 거쳐 변연계·대뇌피질로 진행하는 패턴이 보고된다 (그림 3). 임상적으로는 루이소체 치매·알츠하이머병성 공병리와 자율신경계(심장 교감신경)·장신경계 침범이 비운동 증상을 설명한다.
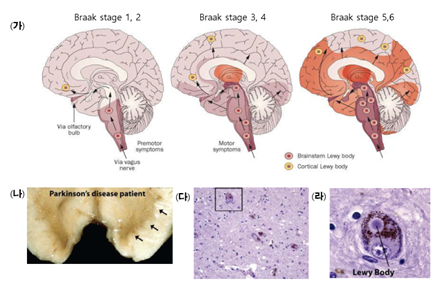
(가) Braak 1–6 단계: 병리 소견은 후각망울과 미주신경핵에서 시작하여 중뇌 흑질을 거쳐 대뇌 피질로 확산되는 것으로 가정된다. (나) 파킨슨병 환자의 중뇌에서 관찰되는 흑질 치밀부 탈색소. (다, 라) 흑질 부위에서 확인된 루이소체(사각형 표시)와 루이신경섬유. (Doty et al. Nature reviews neurology, 2012)
진단과 치료
파킨슨병의 임상 진단은 신경학적 진찰에 기반하며, “서동과 안정시 떨림 또는 경직”으로 정의하는 파킨슨증(parkinsonism)을 확인하고, 다른 질병을 배제하는 과정을 거친다. 고전적인 UK Brain Bank Criteria에 따른 파킨슨병 진단은 3단계 구조이다. ① 파킨슨증이 존재 해야하고 (서동 + 경직/4–6Hz 안정시 떨림/자세불안 중 1개이상의 증상) ② 다른 질병인 경우를 배제하며 (다발성 뇌경색에 의한 계단식 악화, 반복적인 머리외상, 수직핵상마비, 조기에 나타나는 중증 자율실조, 조기 중증 치매, 레보도파 대용량 무반응 등) ③ 다음과 같은 증상이 있을 때 가능성을 높게 본다. (편측 발병, 안정시 떨림, 진행성 경과, 지속 비대칭, 레보도파 탁월한 반응, 레보도파 유발 이상운동증아 나타남, 5년 이상 반응 지속, 10년 이상 임상 경과 등) 따라서 혈액검사나 뇌 자기공명영상 (MRI) 검사로는 파킨슨병 확진을 할 수 없고 신경과 전문의의 신경학적 진찰에 크게 의존한다.
단, 최신 진단 검사들이 개발되어 임상진단을 보강하는데 사용할 수 있다.
1) 양전자 단층촬영 (Positron emission tomography, PET)
파킨슨병은 도파민 신경세포의 감소가 일어나는 질병으로, 뇌의 도파민 신경에 있는 도파민운반체 (dopamine transporter) 밀도를 측정하는 양전자 단층촬영을 통해 진단의 정확도를 높일 수 있다 (그림 4). 이 검사는 도파민을 생성하는 신경세포의 시냅스 전 종말의 도파민운반체에 결합하는 방사성 추적자를 사용하여, 흑색질-선조체 경로(Nigrostriatal pathway)의 도파민 감소를 확인한다. 흑색질 치밀부 신경세포 약 30% 소실 및 선조체 말단 기능의 50–70% 소실이 발생할 경우 운동증상이 나타난다는 보고가 널리 인용되어 왔다.
최근 정량 영상·모형 연구에서는 양전자 단층촬영을 통한 진단 초기의 도파민운반체 저하가 평균 35–45% 수준으로 추정된다는 분석도 제시된다.
파킨슨병과 정상 (혹은 본태성 떨림, 약물유발 파킨슨증)을 구분하는데 있는 도파민운반체 양전자 단층촬영의 민감도·특이도가 97.4%~100% 정도로 높다. 실제로 체계적 문헌고찰에서 임상 진단 대비 민감도 79–100%, 특이도 97–98% 범위가 보고되었다. 반면 파킨슨병과 비정형 파킨슨증후군 사이의 세부 감별은 있는 도파민운반체 양전자 단층촬영만으로는 신뢰도가 낮다. 파킨슨병과 비정형 파킨슨증후군의 구분을 위해서는 자기공명영상, 뇌 포도당 양전자 단층촬영 (¹⁸F-FDG PET)
등의 추가 검사가 도움이 된다.
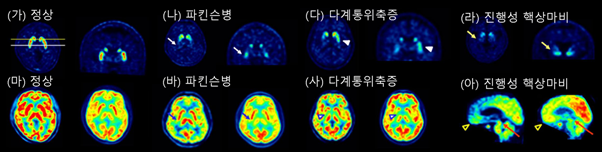
(가, 마) 정상인에서의 도파민 운반체 PET(상)과 뇌 포도당 PET(하). (나, 바) 파킨슨병 환자에서 관찰되는 선조체 도파민 운반체 신호의 비대칭적 감소와 비교적 보존된 뇌대사. (다, 사) 다계통위축증 환자에서의 도파민 운반체 신호 광범위 저하와 기저핵·소뇌·교뇌의 대사 저하. (라, 아) 진행성 핵상마비 환자에서의 도파민 운반체 감소 및 전두엽·중뇌의 대사 저하 소견.
2) 자기공명영상 (Magnetic resonance imaging, MRI)
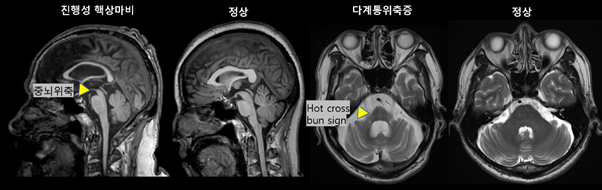
자기공명영상은 파킨슨병 진단보다는, 이차성 파킨슨증 (뇌혈관병변, 수두증, 종양 등)이나 비정형 파킨슨증후군 (진행성 핵상마비, 다계통 위축증 등) 을 감별하는데 큰 가치를 가진다. 예를 들어 비정형 파킨슨증후군 중 진행성 핵상마비는 중뇌 위축(hummingbird/morning-glory sign) 소견이 보이고, 다계통 위축증에서는 자기공명영상 중 교뇌의 ‘hot-cross-bun’ 소견이 보일수 있다 (그림 5). 다만 질환의 유병기간, 중증도에 따라 특이도의 변동이 있어서 단독 확진 근거로는 제한점이 있다.
최근 흑질 표적 자기공명영상을 통해서 나이그로좀을 시각화하여 파킨슨병 초기에 ‘swallow-tail sign’ 소실을 확인할 수 있게됨. 나이그로좀 소실의 위치는 임상적 좌우 비대칭과도 잘 일치하며, 조영제나 방사선이 필요 없고 짧은 시간에 얻을 수 있어 현장 적용성이 높을 수 있다. 향후 재현성, 해상도, 판독 정밀도가 개선되고 표준화가 이루어지면, 진단과 경과 추적에서의 임상적 활용도는 더욱 높아질 것이다.
3) 뇌 포도당 양전자 단층촬영 (¹⁸F-FDG PET)
뇌 포도당 양전자 단층촬영은 도파민 신경세포의 말단이 아니라 뇌 전체의 대사 패턴을 보여 주므로, 파킨슨병과 비정형 파킨슨증후군의 감별을 하는데 강점이 있다. 조기, 경증 파킨슨병에서 FDG-PET은 정상에 가까우며, 인지 저하가 동반되면 두정엽, 후두엽의 대사 저하가 나타날 수 있다. 진행성 핵상마비는 미상핵, 전두부, 중뇌의 대사 저하가 특징이다. 다계통위축증에서는 기저핵, 소뇌, 교뇌의 대사가 저하된다 (그림 4).
4) 향후 사용가능한 진단 목적의 검사.
알파-시누클레인 종자증폭검사(α-syn seeding assay, RT-QuIC/PMCA)는 뇌척수액(CSF)에 존재하는 잘못 접힌 알파-시누클레인의 “씨앗”을 증폭해 검출하는 방법으로, 최근 대규모 코호트에서 높은 진단 성능이 확인되며 임상 적용이 점차 확대되고 있다. 파킨슨병과 직접적으로 연관된 병리인 알파-시누클레인을 확인할 수 있다는 장점이 있으나, 뇌척수액 검사는 비교적 침습적인 검사라는 단점이 있다.
최근에는 피부생검을 통해 피부 신경섬유 내 인산화된 알파-시누클레인을 면역염색으로 확인하는 방법도 시도되고 있다. 2024년 다기관 연구에서 PD 92.7%, MSA 98.2%, DLB 96.0%의 높은 양성률이 보고되었다. 채취 부위(경부, 원위 하지 등)와 절편 두께, 항체, 판독 기준에 따른 변동이 있어 외부검증과 작업공정 표준화가 필요하지만, 임상·영상 소견과 결합하면 초기 감별에 강력한 보조가 될 수 있다.
파킨슨병의 약물치료
표1. 파킨슨병의 경구 치료약제 (Jankovic et al, Principles of movement disorders)
약물군 | 주요 성분/제품(영문) | 제형/특이사항 |
Dopamine precursor (AADC 억제제: carbidopa 또는 benserazide와 병용) | Levodopa (Sinemet, Madopar) | Immediate release 경구제 |
Extended-release levodopa (Sinemet CR, Rytary) | Extended release 경구제 | |
Inhalational levodopa (Inbrija) | 흡입 분말, 속효성 | |
Carbidopa/levodopa (orally disintegrating) (Parcopa) | 구강붕해정 | |
Intestinal gel (Duopa) | 장관 주입 겔(LCIG) | |
Dopamine agonists | Pramipexole (Mirapex) | Immediate release 혹은 extended release 경구제 |
Ropinirole (Requip) | ||
Rotigotine (Neupro) | 경피 패치 | |
Apomorphine (Apokyn, Kynmobi) | 피하 주사, 설하제, 연속주입 | |
NMDA receptor antagonist / 간접 도파민성 | Amantadine | Immediate release 경구제 |
Amantadine extended-release | Extended release 경구제 | |
Levodopa-enhancing agents | COMT inhibitors: entacapone, tolcapone, opicapone | 레보도파 보조(반감기 연장) |
MAO-B inhibitors: selegiline (Eldepryl), Zydis selegiline (Zelapar), rasagiline (Azilect), safinamide (Xadago) | 레보도파 보조(분해 억제) |
1) 레보도파
레보도파는 가장 강력한 증상완화제다. 파킨슨병에서 부족한 도파민은 경구나 혈액을 통해 투약할 경우, 혈액-뇌 장벽(BBB)을 통과하지 못하기 때문에 파킨슨병 치료에 직접 사용되기 어렵다 (그림 6). 또한 도파민을 말초로 투여하면 대부분이 장이나 간에서 MAO, COMT 효소에 의해 빠르게 대사되어 뇌에 도달하기 전에 분해된다. 혈액 속 도파민도 말초 수용체(α, β, 도파민 수용체)를 자극해 오심, 구토, 기립성 저혈압, 빈맥, 부정맥 같은 심혈관·자율신경 부작용을 증가시킨다.
도파민 전구체인 레보도파(L-dopa)는 중성 아미노산 수송체를 통해 혈액-뇌 장벽을 통과하여 뇌 안에서 도파민으로 바뀐다 (그림 6). Cotzias가 1967–1969년에 두 차례, 파킨슨증 환자에서 레보도파를 사용하여 운동증상의 개선 효과를 보고하였고, 1970년에는 미국 FDA가 레보도파를 파킨슨병 치료 목적으로 승인했다. 말초에서의 과도한 도파민 생성으로 인한 부작용을 줄이기 위해 말초 DOPA decarboxylase 억제제가 개발되어 1975년 카비도파/레보도파가 상용화됐고, 같은 기전의 벤세라지드도 임상에 도입됐다.
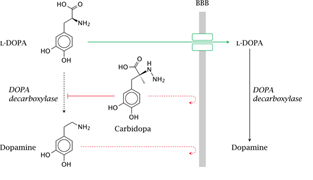
L-DOPA는 중성 아미노산 수송체를 통해 혈액-뇌 장벽(BBB)을 통과한 뒤, 중추에서 DOPA decarboxylase에 의해 도파민으로 전환된다. 카비도파는 말초 DOPA decarboxylase를 억제해 말초 부작용을 줄이면서 중추 도달량을 높인다.
대규모 무작위 연구에서 레보도파로 치료를 시작한 환자들이 도파민 작용제나 MAO-B 억제제부터 시작한 환자보다 삶의 질 개선이 조금 더 컸고, 그 이점은 장기 추적에서도 유지됐다. 다만 질병 진행을 늦추는 ‘질병조절’ 효과는 확인되지 않았고, 사용 기간이 길어질수록 이상운동증과 운동동요의 부담이 커진다. 흔한 부작용은 오심, 기립성 저혈압, 졸림, 환시, 혼동증상 등이며, 특히 고령 취약군에서 정신증상에 유의해야 한다. 그럼에도 불구하고 증상 개선의 효과는 가장 뛰어나다.
장기간 레보도파 사용이 이상운동증 위험을 높일 수 있으나, 운동합병증은 레보도파 사용 시기보다 질병의 진행이나 용량에 영향을 많이 받을 수 있다. 2014년에 발표된 한 연구에서 레보도파 시작을 늦게 하는 가나 환자 91명과, 비교적 레보도파 사용이 빠른 이탈리아 환자 2,282명을 대상으로 추적관찰을 하였다. 가나 환자에서 레보도파 시작이 더 늦었지만, 운동동요, 이상운동증의 유병 비율과 처음 증상이 나타나는 시기는 이탈리아와 유사했다. 다변량 분석에서 운동합병증의 예측인자는 질병 기간과 1일 레보도파 용량(kg당)이었고, 레보도파 노출 기간은 유의하지 않았다. 결론적으로, 레보도파 사용을 늦추기 보다는, 필요한 시점에 적정 용량으로 시작하는 것이 타당하다는 메시지를 제시한다.
2025년 8월 기준 대한민국에서 사용되는 레보도파 제형은 크게 ① 경구 즉시방출(immediate release, IR) 정제(레보도파/카비도파 또는 레보도파/벤세라지드), ② 경구 서방형(continuous release or extended release, CR or ER) 제형(레보도파/카비도파), ③ 엔타카폰을 더한 복합제(레보도파/카비도파/엔타카폰, 예: 스타레보), ④ 장관 주입용 겔(LCIG, Duodopa)이 있다. 엔타카폰 고정복합제는 질병 초기보다는 후기에 나타나는 약효 소진증상 (wearing-off) 조절을 위해 널리 쓰이며 장관 주입용 겔은 2015년 국내 품목허가를 받았으나 급여 비적용으로 제한적으로 활용된다.
최근의 레보도파 제형 개발은 “더 오래, 더 일정하게” 유지되는 목적과 “필요할 때 더 빨리” 작용하는 두 가지 목표로 진화하고 있다. 더 오랜기간 유지를 위한 경구 레보도파 연장형 캡슐이 두 가지가 개발되었다. 2015년 미국 FDA 승인을 받은 Rytary는 레보도파/카비도파를 32% 속방형, 68% 서방형 제재를 사용해 혈중 농도의 변동을 줄이도록 설계되었고, 2024년 승인된 Crexont(IPX203)도 속방형 서방형 입자를 함께 담아 한 번 복용 후 효과 지속 시간을 늘리고 투약 간격을 넓히는 데 초점을 맞췄다. 두 약제 모두 약효 지속기간을 늘리는데 효과를 보였고, 국내에는 아직 사용이 어렵다.
‘필요할 때 즉시 쓰는’ 흡입형 레보도파(Inbrija)는 약효가 떨어지는 OFF 기간의 간헐적 치료를 위해 고안된 구제(rescue) 제형으로, 건조분말을 흡입기 통해 폐로 전달해 빠른 발현을 노린다. 이 약제는 2018년 FDA승인을 받았다. 또한 24시간 피하주입 제형(Vyalev; foscarbidopa/foslevodopa)도 개발되었는데, 이는 레보도파/카비도파 prodrug 용액을 지속 주입해 ‘연속 도파민 자극’을 구현하는 방식으로, 무작위 시험에서 OFF 시간 감소와 문제되지 않는 ON 시간 증가가 확인되어 2024년 FDA 승인을 받았다. 이들 신제형은 장관 주입용 겔(LCIG)과 같은 지속주입 개념을 갖지만, 보다 덜 침습적인 피하주사 방식을 사용하는 장점이 있다. 최근 치료약제 개발로 치료 옵션이 넓어지고 있지만, 상기 약제들은 아직 국내 사용이 어려운 실정이다.
2) 도파민 작용제
도파민 작용제 (프라미펙솔, 로피니롤, 로티고틴 등)는 도파민 수용체에 붙어 신호를 내보내는 기전을 사용한다. 초기 단독요법으로도 운동증상 개선을 입증했고, 레보도파보다는 운동기능 개선 효과가 낮지만, 이상운동 발생률이 낮은 장점이 있다. 반면 부종, 주간 졸림, 환시 같은 부작용에 더해, 충동조절장애 (도박, 과소비, 과식, 과도한 성충동 등)의 위험이 뚜렷이 올라간다. 이상운동증이 적기 때문에 젊은 환자에서 “레보도파 지연” 전략을 위해 도파민 작용제를 고려하지만, 심리사회적 위험인자와 직업 특성(운전, 기계조작 등)을 꼼꼼히 본 뒤 선택하는 것이 안전하다.
국내에서는 아직 사용이 어려운 아포모르핀은 모르핀 (morphine) 분자의 구조에서 수산기를 제거하고 구조를 단순화시킨 반합성 유도체이다. 이름에 “morphine”이 포함되어 있지만, 진통 작용(opioid 효과)은 거의 없고, 마약류로 분류되지 않으며, 도파민 수용체 작용제로 작동한다. 아포모르핀은 경구 투여 시 간의 초회통과 대사로 생체이용률이 매우 낮아 경구제는 사용되지 않는다. 임상에서는 즉각 구제(rescue) 목적으로 쓰이는 피하주사 제형(기존 승인)과, 설하필름형이 활용된다. 두 제형 모두 작용 발현이 빠르다는 장점이 있지만 오심·구토가 흔히 동반될 수 있어, 투여 전 항오심제 전처치를 권장한다.
3) MAO-B 억제제
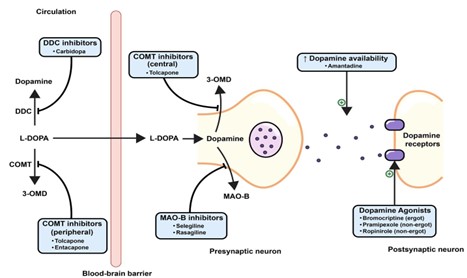
레보도파(L-DOPA)는 혈액-뇌 장벽을 통과하여 중추에서 도파민으로 전환됨. 말초에서는 DOPA decarboxylase 억제제와 COMT 억제제가 레보도파 분해를 막아 중추 도달량을 증가시킨다. 중추에서는 COMT 억제제와 MAO-B 억제제가 도파민 분해를 억제한다. 아만타딘은 시냅스 내 도파민 가용성을 높이고, 도파민 작용제는 직접 도파민 수용체를 자극하여 운동증상 개선 효과를 나타낸다.
MAO-B 억제제(세레길린, 라사길린, 사피나미드)는 선조체 내에서 도파민을 분해하는 효소(MAO-B)를 억제해 시냅스 틈의 도파민 농도를 올린다 (그림 7). 세레길린·라사길린은 비가역 억제제, 사피나미드는 가역 억제제로, 사피나미드는 추가로 글루탐산 방출 조절(Na⁺채널/칼슘 유입 조절)을 통해 운동 증상과 더불어 비운동증상인 통증 관련 증상에 부가 이득을 줄 수 있다. 증상완화 크기는 레보도파보다 작지만, 초기 단독요법에서 완만한 개선을 주고, 레보도파 보조요법으로는 하루 OFF 시간을 약 1시간 안팎 줄이고 ON 시간을 늘리는 근거가 보고된다. MAO-B 억제제는 동물실험에서 질병조절효과가 제시되었지만12, 라사길린의 ADAGIO 지연-시작 연구는 1 mg 조기투여군에서만 긍정 신호를 보여 질병조절 효과는 확정적이지 않다는 결론이다.
4) COMT 억제제
COMT 억제제(엔타카폰, 오피카폰, 톨카폰)는 말초나 중추에서 레보도파를 분해하는 COMT를 막아 반감기를 늘리고 혈중 농도 변동을 완화한다. 임상적으로는 약효가 없는 OFF 구간을 줄이는 데 탁월하다. 엔타카폰은 매회 레보도파와 함께 복용하는 방식으로 OFF 시간을 평균 1–1.5시간 줄이는 효과가 일관되게 관찰된다. 오피카폰은 1일 1회 제제로 편의성이 뛰어나고, 대조군 대비 유의한 OFF 감소와 ON 증가를 보여 약효소진 시 도움이 된다. 다만 레보도파 유발 이상운동증이 늘 수 있다. 설사, 소변 변색 (엔타카폰) 같은 불편 부작용이 있을 수 있고, 톨카폰은 드물지만 심각한 간독성 위험 때문에 사용이 제한된다.
5) 초기 파킨슨병 환자에서의 치료
최근의 진료지침은 생활에 장애를 줄 정도가 아니면 약물 치료없이 지켜볼 수 있으나, 삶의 질을 저하시킬 정도로 불필요하게 참지 않는 것을 권장한다. 한 코호트에 따르면 처음 6개월간 파킨슨병 약을 시작하지 않은 사람들의 67%가 2년내로 약을 시작하였다.
초기 파킨슨병 환자에게는 레보도파, 도파민 작용제, MAO-B 억제제 각각의 이득과 위험을 환자 개별 특성에 맞추어 충분히 설명하고 의사결정을 돕는 것이 권장된다. 초기 파킨슨병에서 운동증상 치료를 원하는 환자에게는 레보도파를 우선 선택하는 것이 권고된다. 다만 60세 미만이며 이상운동증 발생 위험이 상대적으로 큰 일부 환자에서는 도파민 작용제를 초기 도파민성 치료로 처방할 수 있다. 반대로 70세 초과, 충동조절장애 병력, 인지장애, 과도한 주간 졸림 또는 환시가 기존에 있는 환자에게는 도파민 작용제를 초기 치료로 처방하지 않는 것이 바람직하다.
초기 파킨슨병에서는 서방형이나 레보도파/카비도파/엔타카폰 복합제보다 immediate release 레보도파를 먼저 사용하기를 권고한다. 레보도파의 용량은 이상운동증과 기타 부작용을 최소화하기 위해 최소 유효용량으로 시작하여 조심스럽게 증량하는 것이 원칙이다. 레보도파 치료 중에는 운동반응과 이상운동증, 운동동요, 충동조절장애, 주간 과다졸림, 기립성 저혈압, 오심, 환시의 출현을 정기적으로 평가하여 용량을 조정해야 한다. 레보도파의 고용량일수록 이상운동증 위험이 증가함을 환자에게 미리 교육해야 한다. 병이 진행된 단계에서는 식사와 동시 복용이 흡수와 효과에 영향을 줄 수 있으나, 치료 초기에는 보통 큰 문제가 되지 않는다.
도파민 작용제를 처방하기 전에는 환자와 보호자에게 본 약물의 중요 부작용을 충분히 고지해야 하며, 특히 충동조절장애, 주간 과다졸림과 돌발 수면, 오심, 기립성 저혈압, 환시를 구체적으로 설명하는 것이 필요하다. 처방 전 선별평가로 인지기능, 주간 졸림 및 돌발 수면, 환시, 기립성 저혈압, 충동조절장애의 위험요인을 확인하는 것이 권장된다. 도파민 작용제를 사용하는 환자에서는 위와 같은 부작용에 대해 추적 진료마다 반복적으로 선별하고, 가능하면 보호자를 평가에 적극 참여시키는 것이 바람직하다. 필요 시 충동조절장애 선별을 위한 QUIP 설문과 각성 저하 평가를 위한 ESS 설문 등 검증된 설문지를 활용할 수 있다.
따라서 어떤 약을 먼저, 어떻게 조합할지는 환자의 하루 생활 리듬, 직업과 연령, 인지·정신 증상 위험, 동반질환과 복용 약물에 따라 달라진다. 질병이 진행하여 약효 변동이 있을 때에는 COMT 억제제가 도움이 될 수 있으며, 필요하면 제형 전환(서방제, 위장관 흡수 보조)과 분할 투여, 수면, 식습관 조정을 할 수 있다.
파킨슨병의 비약물적 치료
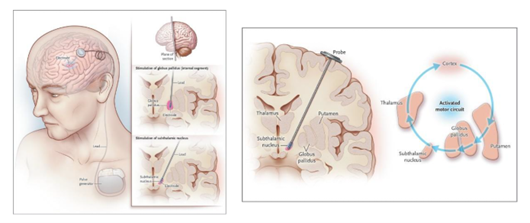
파킨슨병의 수술적 치료는 약물치료로 증상 조절이 어려운 경우 고려되는 효과적인 방법이다. 주로 뇌심부뇌자극술 (Deep brain stimulation, DBS)이 사용되며, 최근에는 집속 초음파 수술(Focused Ultrasound)도 새롭게 시도되고 있다.
1) 뇌심부자극술
뇌심부뇌자극술은 뇌의 특정 부위에 전기 자극을 주는 의료기기를 이식하여 신경 회로를 조절하고 증상을 완화하는 수술이다 (그림 8). 이 수술은 뇌의 비정상적인 신경 신호를 조절하여 떨림, 경직, 서동증 등 운동 증상을 개선한다.
뇌심부자극술은 모든 파킨슨병 환자에게 적용되는 것은 아니며, 1) 운동 동요와 약효 소진 현상(wearing off), 2) 레보도파에 반응이 좋지만 이상운동증(dyskinesia)이 심한 경우 3) 떨림이 심한 경우 고려한다. 뇌심부자극술의 효과가 좋기 위해서는 레보도파 약물에 대한 반응성이 좋아야하며, 인지기능 저하가 없는 경우가 예후가 좋다.
2) MR-유도 집속초음파(Focused Ultrasound, MRgFUS)
고강도 집속 초음파(High-Intensity Focused Ultrasound, HIFU)를 이용하여 뇌 깊숙한 곳의 신경 세포를 파괴하는 방식으로, 주로는 본태성 떨림에 사용되며, 떨림이 심한 파킨슨병 환자에서도 사용될 수 있다. 하지만 아직 운동동요나 이상운동증에 대한 효과는 근거가 제한적이다.
3) 개발되고 있는 질병 조절 치료제
파킨슨병 치료를 위한 신약 개발은 기존의 증상 완화제를 넘어 질병의 진행을 늦추거나 멈추는 질병 조절 치료제(disease-modifying therapy) 개발에 집중되고 있다.
파킨슨병은 뇌의 도파민 신경세포가 손상되면서 발생하는데, 이 과정에서 알파-시누클레인이라는 단백질이 비정상적으로 응집되어 신경세포에 쌓이는 것이 핵심적인 병리이다. 따라서 이 응집 과정을 막거나 이미 응집된 단백질을 제거하는 것이 질병의 근본적인 치료법이 될 수 있다고 보고 있다. 알파-시누클레인을 표적으로 하는 항체 치료제들이 개발되고 있으며, 응집된 알파-시누클레인에 결합하여 신경 독성을 줄이고 세포 간 확산을 막는 역할을 한다. Prasinezumab (Roche/Prothena)은 2상 임상시험에서 주요평가변수가 미충족되었으나, 2b단계에서 일부 하위 탐색 지표에 “지연” 신호가 관찰되어 3상 임상연구를 수행 예정이다.
2025년 4월, 학술지 Nature에 파킨슨병 줄기세포 치료 관련 두 건의 임상 연구 결과가 동시에 발표됐다. 이 논문들은 각각 배아줄기세포(hESC)와 유도만능줄기세포(iPSC)를 이용한 도파민 신경 전구세포 이식의 안전성과 효능을 보고했다. 첫 번째는 BlueRock Therapeutics가 개발한 배아줄기세포(hESC) 유래 도파민 전구세포(bemdaneprocel)를 이용한 1상 임상연구로, 수술을 통해 양측 선조체에 세포를 주입한 뒤 18개월간 추적한 결과 안전성이 입증되었고, PET 영상에서 도파민 신호가 증가하며 고용량군에서 운동 기능 일부 호전과 good ON 시간 연장이 관찰되었다. 중대한 이상반응이나 이식유발 이상운동증(GID)은 보고되지 않았으며, 현재 3상 시험이 개시된 상태다.
두 번째는 교토대학이 주도한 유도만능줄기세포(iPSC) 유래 도파민 전구세포 이식 1/2상으로, 7명의 환자에서 2년간 추적한 결과 역시 중대한 부작용이 없었고, PET에서 투여 용량에 비례해 도파민 합성이 증가하는 신호가 확인되었다. 일부 환자에서는 임상적 운동 기능 호전도 동반되었다. 두 연구 모두 단기간의 안전성과 세포 생착 가능성을 입증하며, 향후 줄기세포가 파킨슨병 치료로 사용될 수 있는 잠재력을 보여주었다는 점에서 큰 의의를 가진다. 두 임상시험 모두 수술을 통해 선조체에 줄기세포를 주입하였고, 정맥주입이나 척수강 내 줄기세포 주입은 효과에 대한 근거가 부족한 실정이다.
이 외에도 GLP-1 작용제, GBA1이나 LRRK2 같은 유전적 파킨슨병에서 기전 특이적인 약물치료, NLRP3 억제제, 장내 마이크로바이옴 치료제들도 임상시험 중에 있다.
파킨슨병은 아직 근본적인 완치법은 없지만, 현재 사용되는 약물치료만으로도 증상 개선 효과가 뚜렷하다는 점에서 조기 진단이 무엇보다 중요하다. 환자마다 증상 양상과 진행 속도가 다르기 때문에 맞춤치료 전략을 세우고, 신경과뿐 아니라 재활의학, 정신건강의학, 영양, 사회복지 등 다양한 분야가 함께하는 다학제적 접근이 필요하다. 이를 통해 환자의 운동 기능뿐 아니라 인지, 정신, 사회적 기능을 개선시킬 수 있다.
또한, 많은 신약과 신기술이 아직 국내에는 도입되지 못하고 있다. 제도적 장벽을 개선하여 해외에서 검증된 치료들이 신속히 환자들에게 제공될 수 있도록 하는 정책적 지원이 필요하다.
앞으로는 알파-시누클레인 항체 치료제, 줄기세포 이식 같은 질병 조절 치료제 연구가 활발히 이어질 것으로 기대된다. 이러한 새로운 치료법이 실제 임상에 도입된다면 단순한 증상 완화를 넘어 질병의 진행을 늦추거나 막는 패러다임 전환이 가능할 것이다.

<필자 프로필>
고려대학교 의과대학 졸
울산대학교 대학원 졸(의학박사)
서울아산병원 신경과 임상전임강사
대한파킨슨병 및 이상운동질환학회 국제학술대회(ICKMDS)우수포스터상(2023)
한국신경학회 젊은연구자상 수상(2024)
렘수면 행동장애의 유무와 질병 진행 단계에 따른 장내 미생물 변화 논문발표(2025)
서울아산병원 신경과 교수
| 인기기사 | 더보기 + |
-
1 비보존제약, 유상증자 추진…전환사채 주식 전환 가능성 공시 -
2 [스페셜리포트] 에임드바이오, 연이은 기술수출 성공…ADC 신흥강자 부상 -
3 오스코텍 “두 번 성공으로 증명 완료…다음은 '항내성 항암신약’” -
4 루닛 "2천억 규모 조달 추진한적 없어..감원 등 비용절감 노력" -
5 올해 잠재적 블록버스터 - 제약 산업 판도 바꿀 치료제는? -
6 리가켐바이오, 오노약품서 ADC 플랫폼 기술이전 마일스톤 수령 -
7 삼천당제약, 류프로렐린 장기지속형 주사제 美 라이선스 텀시트 체결 -
8 "약가제도 개편, 현장 목소리 반영해 재설계해야" -
9 제약계 “시장연동형 실거래가제, 비자발적 가격경쟁 심화” -
10 와이바이오로직스, 중국 ‘우시'와 삼중타깃 면역항암제 CDMO 계약 체결
| 인터뷰 | 더보기 + |
| PEOPLE | 더보기 + |
| 컬쳐/클래시그널 | 더보기 + |

- 이종운 기자 news@yakup.co.kr
- 입력 2026.01.07 06:00 수정 2026.01.07 06:01
개요
파킨슨병(Parkinson’s disease, PD)은 1817년 영국 의사 제임스 파킨슨(James Parkinson)이 ‘An Essay on the Shaking Palsy’에서 처음으로 정의한 질환으로, 이후 신경학적 연구가 발전하면서 기저핵 도파민 신경세포의 퇴행성 변화가 주된 병리 기전임이 밝혀졌다. 전 세계적으로 파킨슨병은 알츠하이머병에 이어 두 번째로 흔한 신경퇴행성 질환이며, 고령화 사회로 접어들수록 그 유병률은 급격히 증가하고 있다. 전 세계 파킨슨병의 추정 유병률은 1990년 약 250만 명에서 2016년 약 610만 명으로 두 배 이상 증가하였으며, 최근에는 2040년경 약 1,200만 명 이상으로 늘어날 것으로 전망된다.
국내 연구에서도 파킨슨병 유병률은 지속적으로 증가하고 있으며, 국민건강보험 데이터를 활용한 분석에 따르면 2004년 파킨슨병 유병률은 3만9,265명에서 2019년 12만5607명으로 3.2배 증가하였다 (그림 1). 최근 유병률 증가의 원인으로는 고령 인구의 급격한 증가, 질환 인식 향상 및 진단 기술 발달, 환경적 요인(농약, 중금속, 대기오염 등)과 생활습관 변화, 생존율 향상에 따른 장기 생존 환자 증가 등이 복합적으로 작용하는 것으로 생각된다.

파킨슨병의 대표적인 운동증상(cardinal motor features)은 서동(bradykinesia), 안정시 진전(resting tremor), 근강직(rigidity), 자세 불안정(postural instability)이며, 이 중 서동은 반드시 존재해야 진단할 수 있는 핵심 증상이다. 이러한 운동증상은 도파민성 신경세포의 소실에 따른 기저핵-피질 회로(basal ganglia-cortical circuit)의 이상으로 설명된다. 병의 후기에는 약 효과가 좋을 때 (ON)과 약 효과가 없을 때 (OFF)의 차이가 나타나는 운동동요와 레보도파 유발 이상운동증이 발생할 수 있다.
한편, 비운동증상(non-motor symptoms)은 운동증상 못지않게 환자의 삶의 질에 심각한 영향을 미치며, 때로는 운동증상보다 먼저 발현하기도 한다 (그림 2). 대표적으로 렘수면행동장애(REM sleep behavior disorder, RBD)는 파킨슨병 발병 수년전에 증상이 나타난다. 장기 추적 연구에 따르면, 특발성 렘수면 행동장애 환자에서 증상 시작 후 5년에는 약 17%, 10년에는 약 40%, 12년에는 약 52%에서 파킨슨병, 루이소체 치매 등 신경퇴행성 질환이 발병하는 것으로 보고되었다. 모든 렘수면 행동장애 환자가 신경퇴행성 질환으로 진행하는 것은 아니지만, 건강 대조군에 비해 발병 위험도가 높기 때문에 주기적인 추적관찰이 필요하다.
그 외에 나타나는 비운동 증상으로는 자율신경계 증상(기립성 저혈압, 변비, 발한 이상), 후각 저하(hyposmia), 인지기능 저하 및 치매, 우울, 불안 등 정신과적 증상이 있다. 파킨슨병의 비운동증상은 단순한 동반 증상을 넘어 환자의 삶의 질을 저하시키는 주요 요인이다. 실제로 여러 연구에서, 파킨슨병 환자의 삶의 질 저하와 돌봄 부담에 미치는 영향은 운동증상보다 비운동증상이 더 크다고 보고된 바 있다. 예를 들어, 자율신경계 이상(기립성 저혈압, 변비, 발한 이상)은 일상생활에 직접적 불편을 초래할 뿐만 아니라 낙상 위험, 영양 불균형, 탈수와 같은 2차적 합병증으로 이어질 수 있다.
또한, 인지기능 저하와 치매는 환자의 독립적인 생활을 불가능하게 만들며, 장기적인 사회·경제적 비용을 크게 증가시킨다. 우울, 불안, 무관심(apathy) 등 정신과적 증상은 환자의 사회적 고립을 심화시키고 치료 순응도를 저하시키는 요인이 된다. 따라서 파킨슨병 관리에 있어 비운동증상은 단순한 부가적 증상이 아니라, 조기 진단, 다학제적 치료 접근, 지속적 모니터링이 필요한 핵심 영역이라 할 수 있다.

운동 증상은 임상적으로 가장 먼저 관찰되는 특징이 있으며, 다양한 비운동증상은 눈에 잘 띄지 않지만, 환자의 삶의 질에 큰 영향을 미친다.
파킨슨병의 핵심 병리는 흑질 치밀부 도파민 신경세포의 점진적 소실과 알파-시누클레인 단백질의 응집이다. 알파-시누클레인 단백질 응집으로 인한 세포질 내 루이소체(Lewy bodies)와 루이신경섬유(Lewy neurites)가 대표적 병리 소견이며, 이에 따른 선조체 도파민 고갈이 운동증상의 기초가 된다. 병변의 공간적 확산은 흔히 Braak 단계로 설명되는데, 후각망울, 미주신경 등 말초, 뇌간 구조에서 시작해 청반, 흑색질을 거쳐 변연계·대뇌피질로 진행하는 패턴이 보고된다 (그림 3). 임상적으로는 루이소체 치매·알츠하이머병성 공병리와 자율신경계(심장 교감신경)·장신경계 침범이 비운동 증상을 설명한다.

(가) Braak 1–6 단계: 병리 소견은 후각망울과 미주신경핵에서 시작하여 중뇌 흑질을 거쳐 대뇌 피질로 확산되는 것으로 가정된다. (나) 파킨슨병 환자의 중뇌에서 관찰되는 흑질 치밀부 탈색소. (다, 라) 흑질 부위에서 확인된 루이소체(사각형 표시)와 루이신경섬유. (Doty et al. Nature reviews neurology, 2012)
진단과 치료
파킨슨병의 임상 진단은 신경학적 진찰에 기반하며, “서동과 안정시 떨림 또는 경직”으로 정의하는 파킨슨증(parkinsonism)을 확인하고, 다른 질병을 배제하는 과정을 거친다. 고전적인 UK Brain Bank Criteria에 따른 파킨슨병 진단은 3단계 구조이다. ① 파킨슨증이 존재 해야하고 (서동 + 경직/4–6Hz 안정시 떨림/자세불안 중 1개이상의 증상) ② 다른 질병인 경우를 배제하며 (다발성 뇌경색에 의한 계단식 악화, 반복적인 머리외상, 수직핵상마비, 조기에 나타나는 중증 자율실조, 조기 중증 치매, 레보도파 대용량 무반응 등) ③ 다음과 같은 증상이 있을 때 가능성을 높게 본다. (편측 발병, 안정시 떨림, 진행성 경과, 지속 비대칭, 레보도파 탁월한 반응, 레보도파 유발 이상운동증아 나타남, 5년 이상 반응 지속, 10년 이상 임상 경과 등) 따라서 혈액검사나 뇌 자기공명영상 (MRI) 검사로는 파킨슨병 확진을 할 수 없고 신경과 전문의의 신경학적 진찰에 크게 의존한다.
단, 최신 진단 검사들이 개발되어 임상진단을 보강하는데 사용할 수 있다.
1) 양전자 단층촬영 (Positron emission tomography, PET)
파킨슨병은 도파민 신경세포의 감소가 일어나는 질병으로, 뇌의 도파민 신경에 있는 도파민운반체 (dopamine transporter) 밀도를 측정하는 양전자 단층촬영을 통해 진단의 정확도를 높일 수 있다 (그림 4). 이 검사는 도파민을 생성하는 신경세포의 시냅스 전 종말의 도파민운반체에 결합하는 방사성 추적자를 사용하여, 흑색질-선조체 경로(Nigrostriatal pathway)의 도파민 감소를 확인한다. 흑색질 치밀부 신경세포 약 30% 소실 및 선조체 말단 기능의 50–70% 소실이 발생할 경우 운동증상이 나타난다는 보고가 널리 인용되어 왔다.
최근 정량 영상·모형 연구에서는 양전자 단층촬영을 통한 진단 초기의 도파민운반체 저하가 평균 35–45% 수준으로 추정된다는 분석도 제시된다.
파킨슨병과 정상 (혹은 본태성 떨림, 약물유발 파킨슨증)을 구분하는데 있는 도파민운반체 양전자 단층촬영의 민감도·특이도가 97.4%~100% 정도로 높다. 실제로 체계적 문헌고찰에서 임상 진단 대비 민감도 79–100%, 특이도 97–98% 범위가 보고되었다. 반면 파킨슨병과 비정형 파킨슨증후군 사이의 세부 감별은 있는 도파민운반체 양전자 단층촬영만으로는 신뢰도가 낮다. 파킨슨병과 비정형 파킨슨증후군의 구분을 위해서는 자기공명영상, 뇌 포도당 양전자 단층촬영 (¹⁸F-FDG PET)
등의 추가 검사가 도움이 된다.

(가, 마) 정상인에서의 도파민 운반체 PET(상)과 뇌 포도당 PET(하). (나, 바) 파킨슨병 환자에서 관찰되는 선조체 도파민 운반체 신호의 비대칭적 감소와 비교적 보존된 뇌대사. (다, 사) 다계통위축증 환자에서의 도파민 운반체 신호 광범위 저하와 기저핵·소뇌·교뇌의 대사 저하. (라, 아) 진행성 핵상마비 환자에서의 도파민 운반체 감소 및 전두엽·중뇌의 대사 저하 소견.
2) 자기공명영상 (Magnetic resonance imaging, MRI)
자기공명영상은 파킨슨병 진단보다는, 이차성 파킨슨증 (뇌혈관병변, 수두증, 종양 등)이나 비정형 파킨슨증후군 (진행성 핵상마비, 다계통 위축증 등) 을 감별하는데 큰 가치를 가진다. 예를 들어 비정형 파킨슨증후군 중 진행성 핵상마비는 중뇌 위축(hummingbird/morning-glory sign) 소견이 보이고, 다계통 위축증에서는 자기공명영상 중 교뇌의 ‘hot-cross-bun’ 소견이 보일수 있다 (그림 5). 다만 질환의 유병기간, 중증도에 따라 특이도의 변동이 있어서 단독 확진 근거로는 제한점이 있다.
최근 흑질 표적 자기공명영상을 통해서 나이그로좀을 시각화하여 파킨슨병 초기에 ‘swallow-tail sign’ 소실을 확인할 수 있게됨. 나이그로좀 소실의 위치는 임상적 좌우 비대칭과도 잘 일치하며, 조영제나 방사선이 필요 없고 짧은 시간에 얻을 수 있어 현장 적용성이 높을 수 있다. 향후 재현성, 해상도, 판독 정밀도가 개선되고 표준화가 이루어지면, 진단과 경과 추적에서의 임상적 활용도는 더욱 높아질 것이다.

3) 뇌 포도당 양전자 단층촬영 (¹⁸F-FDG PET)
뇌 포도당 양전자 단층촬영은 도파민 신경세포의 말단이 아니라 뇌 전체의 대사 패턴을 보여 주므로, 파킨슨병과 비정형 파킨슨증후군의 감별을 하는데 강점이 있다. 조기, 경증 파킨슨병에서 FDG-PET은 정상에 가까우며, 인지 저하가 동반되면 두정엽, 후두엽의 대사 저하가 나타날 수 있다. 진행성 핵상마비는 미상핵, 전두부, 중뇌의 대사 저하가 특징이다. 다계통위축증에서는 기저핵, 소뇌, 교뇌의 대사가 저하된다 (그림 4).
4) 향후 사용가능한 진단 목적의 검사.
알파-시누클레인 종자증폭검사(α-syn seeding assay, RT-QuIC/PMCA)는 뇌척수액(CSF)에 존재하는 잘못 접힌 알파-시누클레인의 “씨앗”을 증폭해 검출하는 방법으로, 최근 대규모 코호트에서 높은 진단 성능이 확인되며 임상 적용이 점차 확대되고 있다. 파킨슨병과 직접적으로 연관된 병리인 알파-시누클레인을 확인할 수 있다는 장점이 있으나, 뇌척수액 검사는 비교적 침습적인 검사라는 단점이 있다.
최근에는 피부생검을 통해 피부 신경섬유 내 인산화된 알파-시누클레인을 면역염색으로 확인하는 방법도 시도되고 있다. 2024년 다기관 연구에서 PD 92.7%, MSA 98.2%, DLB 96.0%의 높은 양성률이 보고되었다. 채취 부위(경부, 원위 하지 등)와 절편 두께, 항체, 판독 기준에 따른 변동이 있어 외부검증과 작업공정 표준화가 필요하지만, 임상·영상 소견과 결합하면 초기 감별에 강력한 보조가 될 수 있다.
파킨슨병의 약물치료
표1. 파킨슨병의 경구 치료약제 (Jankovic et al, Principles of movement disorders)
약물군 | 주요 성분/제품(영문) | 제형/특이사항 |
Dopamine precursor (AADC 억제제: carbidopa 또는 benserazide와 병용) | Levodopa (Sinemet, Madopar) | Immediate release 경구제 |
Extended-release levodopa (Sinemet CR, Rytary) | Extended release 경구제 | |
Inhalational levodopa (Inbrija) | 흡입 분말, 속효성 | |
Carbidopa/levodopa (orally disintegrating) (Parcopa) | 구강붕해정 | |
Intestinal gel (Duopa) | 장관 주입 겔(LCIG) | |
Dopamine agonists | Pramipexole (Mirapex) | Immediate release 혹은 extended release 경구제 |
Ropinirole (Requip) | ||
Rotigotine (Neupro) | 경피 패치 | |
Apomorphine (Apokyn, Kynmobi) | 피하 주사, 설하제, 연속주입 | |
NMDA receptor antagonist / 간접 도파민성 | Amantadine | Immediate release 경구제 |
Amantadine extended-release | Extended release 경구제 | |
Levodopa-enhancing agents | COMT inhibitors: entacapone, tolcapone, opicapone | 레보도파 보조(반감기 연장) |
MAO-B inhibitors: selegiline (Eldepryl), Zydis selegiline (Zelapar), rasagiline (Azilect), safinamide (Xadago) | 레보도파 보조(분해 억제) |
1) 레보도파
레보도파는 가장 강력한 증상완화제다. 파킨슨병에서 부족한 도파민은 경구나 혈액을 통해 투약할 경우, 혈액-뇌 장벽(BBB)을 통과하지 못하기 때문에 파킨슨병 치료에 직접 사용되기 어렵다 (그림 6). 또한 도파민을 말초로 투여하면 대부분이 장이나 간에서 MAO, COMT 효소에 의해 빠르게 대사되어 뇌에 도달하기 전에 분해된다. 혈액 속 도파민도 말초 수용체(α, β, 도파민 수용체)를 자극해 오심, 구토, 기립성 저혈압, 빈맥, 부정맥 같은 심혈관·자율신경 부작용을 증가시킨다.
도파민 전구체인 레보도파(L-dopa)는 중성 아미노산 수송체를 통해 혈액-뇌 장벽을 통과하여 뇌 안에서 도파민으로 바뀐다 (그림 6). Cotzias가 1967–1969년에 두 차례, 파킨슨증 환자에서 레보도파를 사용하여 운동증상의 개선 효과를 보고하였고, 1970년에는 미국 FDA가 레보도파를 파킨슨병 치료 목적으로 승인했다. 말초에서의 과도한 도파민 생성으로 인한 부작용을 줄이기 위해 말초 DOPA decarboxylase 억제제가 개발되어 1975년 카비도파/레보도파가 상용화됐고, 같은 기전의 벤세라지드도 임상에 도입됐다.

L-DOPA는 중성 아미노산 수송체를 통해 혈액-뇌 장벽(BBB)을 통과한 뒤, 중추에서 DOPA decarboxylase에 의해 도파민으로 전환된다. 카비도파는 말초 DOPA decarboxylase를 억제해 말초 부작용을 줄이면서 중추 도달량을 높인다.
대규모 무작위 연구에서 레보도파로 치료를 시작한 환자들이 도파민 작용제나 MAO-B 억제제부터 시작한 환자보다 삶의 질 개선이 조금 더 컸고, 그 이점은 장기 추적에서도 유지됐다. 다만 질병 진행을 늦추는 ‘질병조절’ 효과는 확인되지 않았고, 사용 기간이 길어질수록 이상운동증과 운동동요의 부담이 커진다. 흔한 부작용은 오심, 기립성 저혈압, 졸림, 환시, 혼동증상 등이며, 특히 고령 취약군에서 정신증상에 유의해야 한다. 그럼에도 불구하고 증상 개선의 효과는 가장 뛰어나다.
장기간 레보도파 사용이 이상운동증 위험을 높일 수 있으나, 운동합병증은 레보도파 사용 시기보다 질병의 진행이나 용량에 영향을 많이 받을 수 있다. 2014년에 발표된 한 연구에서 레보도파 시작을 늦게 하는 가나 환자 91명과, 비교적 레보도파 사용이 빠른 이탈리아 환자 2,282명을 대상으로 추적관찰을 하였다. 가나 환자에서 레보도파 시작이 더 늦었지만, 운동동요, 이상운동증의 유병 비율과 처음 증상이 나타나는 시기는 이탈리아와 유사했다. 다변량 분석에서 운동합병증의 예측인자는 질병 기간과 1일 레보도파 용량(kg당)이었고, 레보도파 노출 기간은 유의하지 않았다. 결론적으로, 레보도파 사용을 늦추기 보다는, 필요한 시점에 적정 용량으로 시작하는 것이 타당하다는 메시지를 제시한다.
2025년 8월 기준 대한민국에서 사용되는 레보도파 제형은 크게 ① 경구 즉시방출(immediate release, IR) 정제(레보도파/카비도파 또는 레보도파/벤세라지드), ② 경구 서방형(continuous release or extended release, CR or ER) 제형(레보도파/카비도파), ③ 엔타카폰을 더한 복합제(레보도파/카비도파/엔타카폰, 예: 스타레보), ④ 장관 주입용 겔(LCIG, Duodopa)이 있다. 엔타카폰 고정복합제는 질병 초기보다는 후기에 나타나는 약효 소진증상 (wearing-off) 조절을 위해 널리 쓰이며 장관 주입용 겔은 2015년 국내 품목허가를 받았으나 급여 비적용으로 제한적으로 활용된다.
최근의 레보도파 제형 개발은 “더 오래, 더 일정하게” 유지되는 목적과 “필요할 때 더 빨리” 작용하는 두 가지 목표로 진화하고 있다. 더 오랜기간 유지를 위한 경구 레보도파 연장형 캡슐이 두 가지가 개발되었다. 2015년 미국 FDA 승인을 받은 Rytary는 레보도파/카비도파를 32% 속방형, 68% 서방형 제재를 사용해 혈중 농도의 변동을 줄이도록 설계되었고, 2024년 승인된 Crexont(IPX203)도 속방형 서방형 입자를 함께 담아 한 번 복용 후 효과 지속 시간을 늘리고 투약 간격을 넓히는 데 초점을 맞췄다. 두 약제 모두 약효 지속기간을 늘리는데 효과를 보였고, 국내에는 아직 사용이 어렵다.
‘필요할 때 즉시 쓰는’ 흡입형 레보도파(Inbrija)는 약효가 떨어지는 OFF 기간의 간헐적 치료를 위해 고안된 구제(rescue) 제형으로, 건조분말을 흡입기 통해 폐로 전달해 빠른 발현을 노린다. 이 약제는 2018년 FDA승인을 받았다. 또한 24시간 피하주입 제형(Vyalev; foscarbidopa/foslevodopa)도 개발되었는데, 이는 레보도파/카비도파 prodrug 용액을 지속 주입해 ‘연속 도파민 자극’을 구현하는 방식으로, 무작위 시험에서 OFF 시간 감소와 문제되지 않는 ON 시간 증가가 확인되어 2024년 FDA 승인을 받았다. 이들 신제형은 장관 주입용 겔(LCIG)과 같은 지속주입 개념을 갖지만, 보다 덜 침습적인 피하주사 방식을 사용하는 장점이 있다. 최근 치료약제 개발로 치료 옵션이 넓어지고 있지만, 상기 약제들은 아직 국내 사용이 어려운 실정이다.
2) 도파민 작용제
도파민 작용제 (프라미펙솔, 로피니롤, 로티고틴 등)는 도파민 수용체에 붙어 신호를 내보내는 기전을 사용한다. 초기 단독요법으로도 운동증상 개선을 입증했고, 레보도파보다는 운동기능 개선 효과가 낮지만, 이상운동 발생률이 낮은 장점이 있다. 반면 부종, 주간 졸림, 환시 같은 부작용에 더해, 충동조절장애 (도박, 과소비, 과식, 과도한 성충동 등)의 위험이 뚜렷이 올라간다. 이상운동증이 적기 때문에 젊은 환자에서 “레보도파 지연” 전략을 위해 도파민 작용제를 고려하지만, 심리사회적 위험인자와 직업 특성(운전, 기계조작 등)을 꼼꼼히 본 뒤 선택하는 것이 안전하다.
국내에서는 아직 사용이 어려운 아포모르핀은 모르핀 (morphine) 분자의 구조에서 수산기를 제거하고 구조를 단순화시킨 반합성 유도체이다. 이름에 “morphine”이 포함되어 있지만, 진통 작용(opioid 효과)은 거의 없고, 마약류로 분류되지 않으며, 도파민 수용체 작용제로 작동한다. 아포모르핀은 경구 투여 시 간의 초회통과 대사로 생체이용률이 매우 낮아 경구제는 사용되지 않는다. 임상에서는 즉각 구제(rescue) 목적으로 쓰이는 피하주사 제형(기존 승인)과, 설하필름형이 활용된다. 두 제형 모두 작용 발현이 빠르다는 장점이 있지만 오심·구토가 흔히 동반될 수 있어, 투여 전 항오심제 전처치를 권장한다.
3) MAO-B 억제제

레보도파(L-DOPA)는 혈액-뇌 장벽을 통과하여 중추에서 도파민으로 전환됨. 말초에서는 DOPA decarboxylase 억제제와 COMT 억제제가 레보도파 분해를 막아 중추 도달량을 증가시킨다. 중추에서는 COMT 억제제와 MAO-B 억제제가 도파민 분해를 억제한다. 아만타딘은 시냅스 내 도파민 가용성을 높이고, 도파민 작용제는 직접 도파민 수용체를 자극하여 운동증상 개선 효과를 나타낸다.
MAO-B 억제제(세레길린, 라사길린, 사피나미드)는 선조체 내에서 도파민을 분해하는 효소(MAO-B)를 억제해 시냅스 틈의 도파민 농도를 올린다 (그림 7). 세레길린·라사길린은 비가역 억제제, 사피나미드는 가역 억제제로, 사피나미드는 추가로 글루탐산 방출 조절(Na⁺채널/칼슘 유입 조절)을 통해 운동 증상과 더불어 비운동증상인 통증 관련 증상에 부가 이득을 줄 수 있다. 증상완화 크기는 레보도파보다 작지만, 초기 단독요법에서 완만한 개선을 주고, 레보도파 보조요법으로는 하루 OFF 시간을 약 1시간 안팎 줄이고 ON 시간을 늘리는 근거가 보고된다. MAO-B 억제제는 동물실험에서 질병조절효과가 제시되었지만12, 라사길린의 ADAGIO 지연-시작 연구는 1 mg 조기투여군에서만 긍정 신호를 보여 질병조절 효과는 확정적이지 않다는 결론이다.
4) COMT 억제제
COMT 억제제(엔타카폰, 오피카폰, 톨카폰)는 말초나 중추에서 레보도파를 분해하는 COMT를 막아 반감기를 늘리고 혈중 농도 변동을 완화한다. 임상적으로는 약효가 없는 OFF 구간을 줄이는 데 탁월하다. 엔타카폰은 매회 레보도파와 함께 복용하는 방식으로 OFF 시간을 평균 1–1.5시간 줄이는 효과가 일관되게 관찰된다. 오피카폰은 1일 1회 제제로 편의성이 뛰어나고, 대조군 대비 유의한 OFF 감소와 ON 증가를 보여 약효소진 시 도움이 된다. 다만 레보도파 유발 이상운동증이 늘 수 있다. 설사, 소변 변색 (엔타카폰) 같은 불편 부작용이 있을 수 있고, 톨카폰은 드물지만 심각한 간독성 위험 때문에 사용이 제한된다.
5) 초기 파킨슨병 환자에서의 치료
최근의 진료지침은 생활에 장애를 줄 정도가 아니면 약물 치료없이 지켜볼 수 있으나, 삶의 질을 저하시킬 정도로 불필요하게 참지 않는 것을 권장한다. 한 코호트에 따르면 처음 6개월간 파킨슨병 약을 시작하지 않은 사람들의 67%가 2년내로 약을 시작하였다.
초기 파킨슨병 환자에게는 레보도파, 도파민 작용제, MAO-B 억제제 각각의 이득과 위험을 환자 개별 특성에 맞추어 충분히 설명하고 의사결정을 돕는 것이 권장된다. 초기 파킨슨병에서 운동증상 치료를 원하는 환자에게는 레보도파를 우선 선택하는 것이 권고된다. 다만 60세 미만이며 이상운동증 발생 위험이 상대적으로 큰 일부 환자에서는 도파민 작용제를 초기 도파민성 치료로 처방할 수 있다. 반대로 70세 초과, 충동조절장애 병력, 인지장애, 과도한 주간 졸림 또는 환시가 기존에 있는 환자에게는 도파민 작용제를 초기 치료로 처방하지 않는 것이 바람직하다.
초기 파킨슨병에서는 서방형이나 레보도파/카비도파/엔타카폰 복합제보다 immediate release 레보도파를 먼저 사용하기를 권고한다. 레보도파의 용량은 이상운동증과 기타 부작용을 최소화하기 위해 최소 유효용량으로 시작하여 조심스럽게 증량하는 것이 원칙이다. 레보도파 치료 중에는 운동반응과 이상운동증, 운동동요, 충동조절장애, 주간 과다졸림, 기립성 저혈압, 오심, 환시의 출현을 정기적으로 평가하여 용량을 조정해야 한다. 레보도파의 고용량일수록 이상운동증 위험이 증가함을 환자에게 미리 교육해야 한다. 병이 진행된 단계에서는 식사와 동시 복용이 흡수와 효과에 영향을 줄 수 있으나, 치료 초기에는 보통 큰 문제가 되지 않는다.
도파민 작용제를 처방하기 전에는 환자와 보호자에게 본 약물의 중요 부작용을 충분히 고지해야 하며, 특히 충동조절장애, 주간 과다졸림과 돌발 수면, 오심, 기립성 저혈압, 환시를 구체적으로 설명하는 것이 필요하다. 처방 전 선별평가로 인지기능, 주간 졸림 및 돌발 수면, 환시, 기립성 저혈압, 충동조절장애의 위험요인을 확인하는 것이 권장된다. 도파민 작용제를 사용하는 환자에서는 위와 같은 부작용에 대해 추적 진료마다 반복적으로 선별하고, 가능하면 보호자를 평가에 적극 참여시키는 것이 바람직하다. 필요 시 충동조절장애 선별을 위한 QUIP 설문과 각성 저하 평가를 위한 ESS 설문 등 검증된 설문지를 활용할 수 있다.
따라서 어떤 약을 먼저, 어떻게 조합할지는 환자의 하루 생활 리듬, 직업과 연령, 인지·정신 증상 위험, 동반질환과 복용 약물에 따라 달라진다. 질병이 진행하여 약효 변동이 있을 때에는 COMT 억제제가 도움이 될 수 있으며, 필요하면 제형 전환(서방제, 위장관 흡수 보조)과 분할 투여, 수면, 식습관 조정을 할 수 있다.
파킨슨병의 비약물적 치료

파킨슨병의 수술적 치료는 약물치료로 증상 조절이 어려운 경우 고려되는 효과적인 방법이다. 주로 뇌심부뇌자극술 (Deep brain stimulation, DBS)이 사용되며, 최근에는 집속 초음파 수술(Focused Ultrasound)도 새롭게 시도되고 있다.
1) 뇌심부자극술
뇌심부뇌자극술은 뇌의 특정 부위에 전기 자극을 주는 의료기기를 이식하여 신경 회로를 조절하고 증상을 완화하는 수술이다 (그림 8). 이 수술은 뇌의 비정상적인 신경 신호를 조절하여 떨림, 경직, 서동증 등 운동 증상을 개선한다.
뇌심부자극술은 모든 파킨슨병 환자에게 적용되는 것은 아니며, 1) 운동 동요와 약효 소진 현상(wearing off), 2) 레보도파에 반응이 좋지만 이상운동증(dyskinesia)이 심한 경우 3) 떨림이 심한 경우 고려한다. 뇌심부자극술의 효과가 좋기 위해서는 레보도파 약물에 대한 반응성이 좋아야하며, 인지기능 저하가 없는 경우가 예후가 좋다.
2) MR-유도 집속초음파(Focused Ultrasound, MRgFUS)
고강도 집속 초음파(High-Intensity Focused Ultrasound, HIFU)를 이용하여 뇌 깊숙한 곳의 신경 세포를 파괴하는 방식으로, 주로는 본태성 떨림에 사용되며, 떨림이 심한 파킨슨병 환자에서도 사용될 수 있다. 하지만 아직 운동동요나 이상운동증에 대한 효과는 근거가 제한적이다.
3) 개발되고 있는 질병 조절 치료제
파킨슨병 치료를 위한 신약 개발은 기존의 증상 완화제를 넘어 질병의 진행을 늦추거나 멈추는 질병 조절 치료제(disease-modifying therapy) 개발에 집중되고 있다.
파킨슨병은 뇌의 도파민 신경세포가 손상되면서 발생하는데, 이 과정에서 알파-시누클레인이라는 단백질이 비정상적으로 응집되어 신경세포에 쌓이는 것이 핵심적인 병리이다. 따라서 이 응집 과정을 막거나 이미 응집된 단백질을 제거하는 것이 질병의 근본적인 치료법이 될 수 있다고 보고 있다. 알파-시누클레인을 표적으로 하는 항체 치료제들이 개발되고 있으며, 응집된 알파-시누클레인에 결합하여 신경 독성을 줄이고 세포 간 확산을 막는 역할을 한다. Prasinezumab (Roche/Prothena)은 2상 임상시험에서 주요평가변수가 미충족되었으나, 2b단계에서 일부 하위 탐색 지표에 “지연” 신호가 관찰되어 3상 임상연구를 수행 예정이다.
2025년 4월, 학술지 Nature에 파킨슨병 줄기세포 치료 관련 두 건의 임상 연구 결과가 동시에 발표됐다. 이 논문들은 각각 배아줄기세포(hESC)와 유도만능줄기세포(iPSC)를 이용한 도파민 신경 전구세포 이식의 안전성과 효능을 보고했다. 첫 번째는 BlueRock Therapeutics가 개발한 배아줄기세포(hESC) 유래 도파민 전구세포(bemdaneprocel)를 이용한 1상 임상연구로, 수술을 통해 양측 선조체에 세포를 주입한 뒤 18개월간 추적한 결과 안전성이 입증되었고, PET 영상에서 도파민 신호가 증가하며 고용량군에서 운동 기능 일부 호전과 good ON 시간 연장이 관찰되었다. 중대한 이상반응이나 이식유발 이상운동증(GID)은 보고되지 않았으며, 현재 3상 시험이 개시된 상태다.
두 번째는 교토대학이 주도한 유도만능줄기세포(iPSC) 유래 도파민 전구세포 이식 1/2상으로, 7명의 환자에서 2년간 추적한 결과 역시 중대한 부작용이 없었고, PET에서 투여 용량에 비례해 도파민 합성이 증가하는 신호가 확인되었다. 일부 환자에서는 임상적 운동 기능 호전도 동반되었다. 두 연구 모두 단기간의 안전성과 세포 생착 가능성을 입증하며, 향후 줄기세포가 파킨슨병 치료로 사용될 수 있는 잠재력을 보여주었다는 점에서 큰 의의를 가진다. 두 임상시험 모두 수술을 통해 선조체에 줄기세포를 주입하였고, 정맥주입이나 척수강 내 줄기세포 주입은 효과에 대한 근거가 부족한 실정이다.
이 외에도 GLP-1 작용제, GBA1이나 LRRK2 같은 유전적 파킨슨병에서 기전 특이적인 약물치료, NLRP3 억제제, 장내 마이크로바이옴 치료제들도 임상시험 중에 있다.
파킨슨병은 아직 근본적인 완치법은 없지만, 현재 사용되는 약물치료만으로도 증상 개선 효과가 뚜렷하다는 점에서 조기 진단이 무엇보다 중요하다. 환자마다 증상 양상과 진행 속도가 다르기 때문에 맞춤치료 전략을 세우고, 신경과뿐 아니라 재활의학, 정신건강의학, 영양, 사회복지 등 다양한 분야가 함께하는 다학제적 접근이 필요하다. 이를 통해 환자의 운동 기능뿐 아니라 인지, 정신, 사회적 기능을 개선시킬 수 있다.
또한, 많은 신약과 신기술이 아직 국내에는 도입되지 못하고 있다. 제도적 장벽을 개선하여 해외에서 검증된 치료들이 신속히 환자들에게 제공될 수 있도록 하는 정책적 지원이 필요하다.
앞으로는 알파-시누클레인 항체 치료제, 줄기세포 이식 같은 질병 조절 치료제 연구가 활발히 이어질 것으로 기대된다. 이러한 새로운 치료법이 실제 임상에 도입된다면 단순한 증상 완화를 넘어 질병의 진행을 늦추거나 막는 패러다임 전환이 가능할 것이다.

<필자 프로필>
고려대학교 의과대학 졸
울산대학교 대학원 졸(의학박사)
서울아산병원 신경과 임상전임강사
대한파킨슨병 및 이상운동질환학회 국제학술대회(ICKMDS)우수포스터상(2023)
한국신경학회 젊은연구자상 수상(2024)
렘수면 행동장애의 유무와 질병 진행 단계에 따른 장내 미생물 변화 논문발표(2025)
서울아산병원 신경과 교수
무단 전재·복사·배포 등을 금지합니다.



 기자가 쓴 기사 더보기
기자가 쓴 기사 더보기
