허가특허연계제도 2년, 제네릭사 매출 9~14억원↑
오리지널사 매출 16~22억원↓…약품비는 7~9억원↓
식약처 "국내 제약산업·보건정책에 미치는 영향 적은 편"
식약처 "국내 제약산업·보건정책에 미치는 영향 적은 편"
입력 2017.12.29 06:00
수정 2017.12.29 06:41
허가특허연계제도 시행 이후 2년 간 제네릭사의 매출이 약 9~14억 정도 증가하고, 오리지널사가 16~22억 가량 감소됐다고 측정된 가운데, 국내에 미치는 영향이 크지 않은 것으로 평가됐다.
이번 연구는 서울대 산학협력단(연구책임자 이태진 교수)이 허가특허연계제도 시행 후 2년간(2015년 3월~2017년 3월) 제약산업 등에 미치는 영향을 산출, 직접영향, 간접영향 등 3개 영역으로 구분·평가했다.
평가 주요 결과를 보면, 판매금지 기간은 1.4~1.7개월 정도로 지연됐고, 우선판매로 인해서는 4.6~8.2개월 조기진입했다. 약품비는 약 7~8억원 감소(판매금지 1.8~3.6억↑, 우선판매 9.4~12.8억↓)했다.
제네릭사 매출은 약 9~14억원 증가(판매금지 0.6~2.2억↓, 우선판매 10~16억↑)했으며, 오리지널사 매출은 약 16~22억원 감소(판매금지 2.4~5.9억↑, 우선판매 18~28억↓)했다.
이에 대해 식약처는 "제도 도입 시 오리지널사의 판매금지조치로 인한 제네릭의약품의 시장진입지연, 그로 인한 건강보험 약품비 증가 및 제약기업매출 감소 등 부정적 영향에 대한 우려가 많았으나, 국내 제약산업·보건정책에 미치는 영향은 크지 않은 것으로"고 설명했다.
이어 "오리지널사의 판매금지 신청건수가 많지 않았고, 우선판매품목허가제도의 영향으로 제네릭의약품의 시장진입이 다소 앞당겨진 것으로 분석된다"며 "그 결과 판매금지, 우선판매품목허가 등 허가특허연계제도 시행에 따른 약품비 및 제약사 매출변화는 매우 낮은 수준으로 평가된다"고 부연했다.
다만 "현재 제도 시행 초기로 영향평가를 위한 분석 대상·기간이 충분하지 않은 점을 고려할 때 중장기적으로 지속 검토·분석할 필요가 있다"고 여지를 두기도 했다.

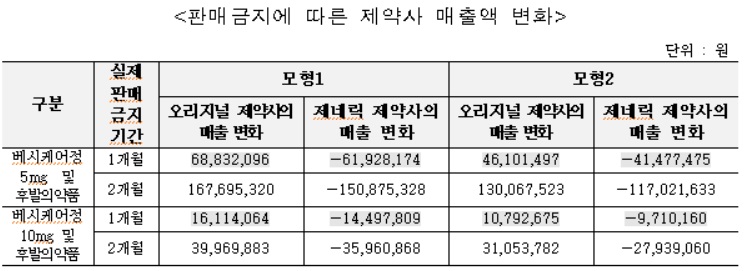
직접영향[판매금지]= 평가대상 의약품은 평가기간 중 판매금지가 종료(효력 소멸, 기간 만료)된 21개 품목으로, 통풍치료제인 페브릭정 2개 품목(40mg, 80mg) 관련 판매금지처분을 받은 후발의약품 19개 품목(40mg 9개, 80mg 10개)과 과민성방광증 치료제인 베시케어정 2개 품목(5mg, 10mg) 관련 판매금지처분을 받은 후발의약품 2개 품목(5mg 1개, 10mg 1개)이다.
페브릭정 후발의약품의 실제 판매금지기간은 평균 42일(1.4개월)로 법령상 가능한 최대 판매금지기간(통지수령일로부터 9개월) 보다 단축됐다.
베시케어정 후발의약품의 실제 판매금지기간은 평균 50일(1.7개월)로 법령상 가능한 최대 판매금지기간(통지수령일로부터 9개월)보다 단축됐다.
페브릭정 후발의약품의 약품비 지출은 판매금지에 따른 시장 진입 지연으로 실제 판매금지기간에 따라 약 1억7,700∼3억4,200만원(모형 1기준), 약 1억7,700∼3억4,100만원(모형 2기준) 증가한 것으로 추정됐다.
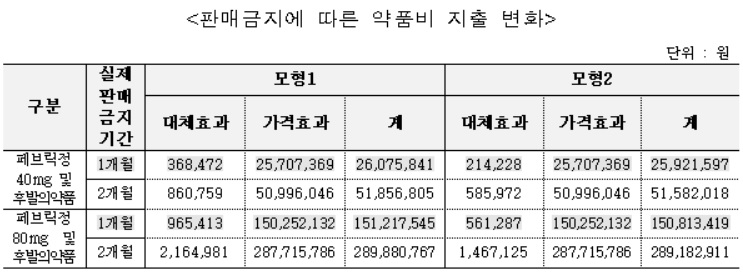
베시케어정 후발의약품의 약품비 지출은 판매금지에 따른 시장 진입 지연으로 실제 판매금지기간에 따라 약 900∼2,100만원(모형 1기준), 약 600∼1,600만원(모형 2기준) 증가한 것으로 추정됐다.
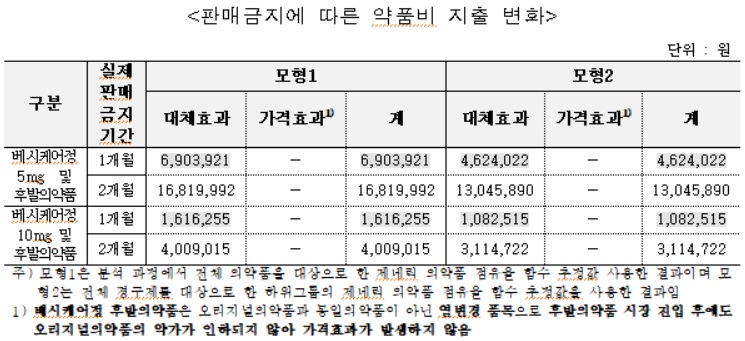
페브릭정 후발의약품의 판매금지에 따른 시장 진입 지연으로 판매금지가 없었을 경우에 비해 오리지널 제약사의 매출은 실제판매금지기간에 따라 약 1억9,300∼3억7,900원(모형 1기준), 약 1억8,600~3억6,600만원 증가(모형 2기준)가 추정됐다.
제네릭 제약사의 매출은 실제판매금지기간에 따라 약 1,600∼3,700만원(모형 1기준), 약 900~2,300만원(모형 2기준) 감소가 추정됐다.
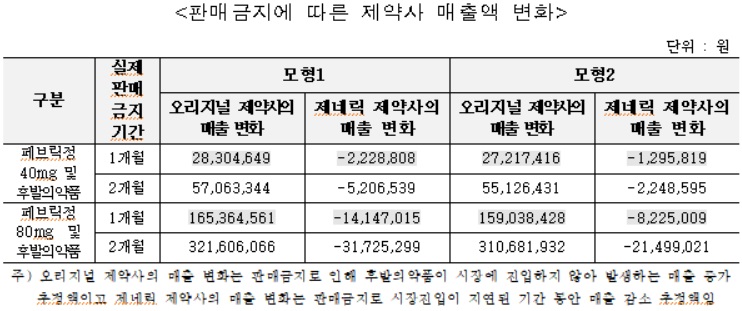
베시케어정 후발의약품의 경우 판매금지에 따른 시장 진입 지연으로 판매금지가 없었을 경우에 비해, 오리지널 제약사의 매출은 실제판매금지기간에 따라 약 8,500∼2억800만원(모형 1기준), 약 5,700~1억6,100만원(모형 2기준) 증가가 추정됐다.
제네릭 제약사의 매출은 실제판매금지기간에 따라 약 7,600∼1억8,700만원(모형 1기준), 약 5,100~1억4,500만원(모형 2기준) 감소가 추정됐다.
시장점유율 분석 결과에서는 평가대상의약품 모두 제네릭 의약품 시장점유율 추정값에 비해 다소 높거나 비슷한 점유율을 보였다.
직접영향[우선판매품목허가]= 평가대상 의약품은 평가기간에 우선판매품목허가가 종료된 75개 품목이다.
구체적으로는 아모잘탄정 3개 품목(5/100mg, 5/50mg, 10/50mg)에 대해 우선판매품목허가를 받은 후발의약품 45개 품목(5/100mg 16개, 5/50mg 20개, 10/50mg 9개)과 스타레보필름코팅정 4개 품목(50/12.5/200mg, 75/18.75/200mg, 100/25/200mg, 125/31.25/200mg)에 대해 우선판매품목허가를 받은 후발의약품 11개 품목(50/12.5/200mg 3개, 75/18.75/200mg 3개, 100/25/200mg 2개, 125/31.25/200mg 3개), 페브릭정 2개 품목(40mg, 80mg)에 대해 우선판매품목허가를 받은 후발의약품 17개 품목(40mg 9개, 80mg 8개), 심비코트터부헬러 2개 품목(160/4.5mcg, 320/9mcg)에 대해 우선판매품목허가를 받은 후발의약품 2개 품목이다.
분석 결과, 아모잘탄정 후발의약품은 우선판매품목허가를 획득하지 못했을 경우에 비해 약 8.2개월 조기 진입한 것으로 나타났고, 스타레보필름코팅정 후발의약품은 약 4.6~8개월 조기 진입한 것으로 나타났다.
페브릭정 후발의약품은 약 4.6개월 조기 진입했고, 심비코트터부헬러 후발의약품은 0개월 조기 진입한 것으로 나타났다.
아모잘탄정, 심비코트터부헬러 후발의약품의 경우 제네릭 의약품 시장점유율 추정값에 비해 낮음, 페브릭정 후발의약품은 다소 높음으로 나타났다. 스타레보필름코팅정 후발의약품의 경우 진입초기 낮은 점유율을 보이다 13개월 시점 이후 제네릭 의약품 시장점유율 추정값 보다 높은 점유율을 보였다.
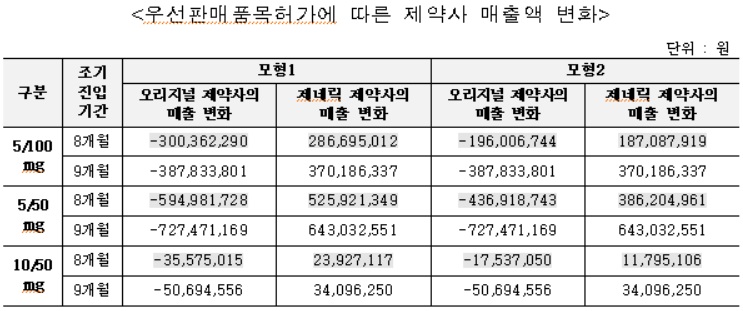
아모잘탄정 후발의약품의 약품비 지출은 조기진입 기간에 따라 약 9,500~1억1,900만원(모형 1기준), 약 6,600~1억1,900만원(모형 2기준) 감소한 것으로 추정됐다.
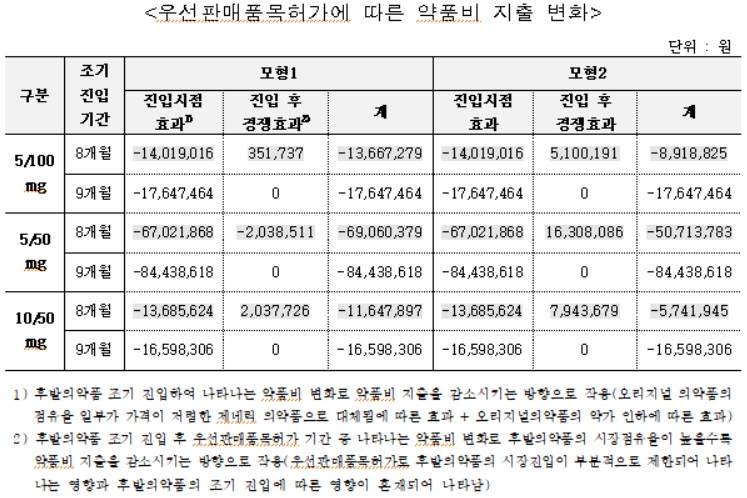
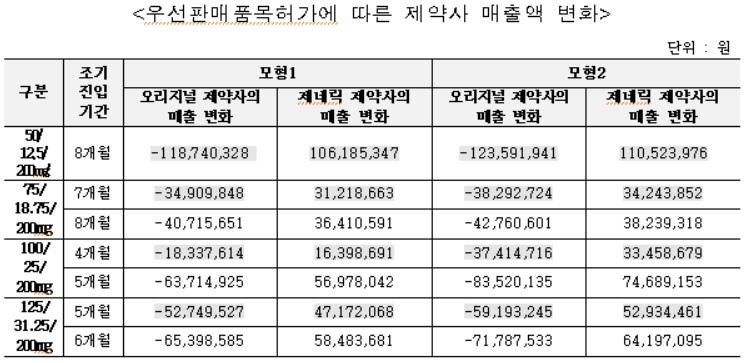
스타레보필름코팅정 후발의약품의 약품비 지출은 조기진입 기간에 따라 약 2,500~3,100(모형 1기준), 약 2,700~3,500만원(모형 2기준) 감소한 것으로 추정됐다.
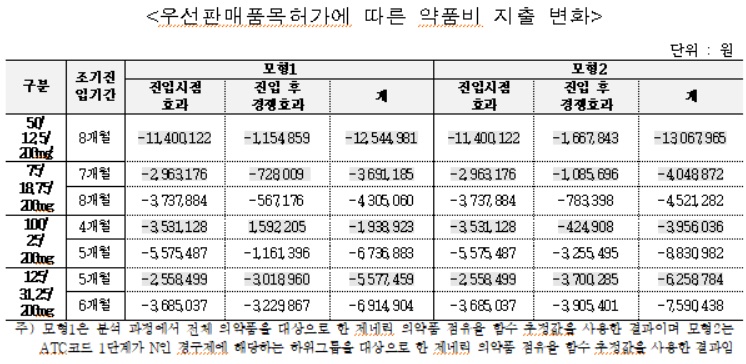
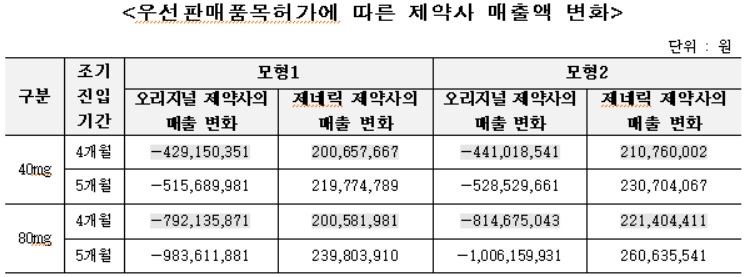
페브릭정 후발의약품의 약품비 지출은 조기진입 기간에 따라 약 8억2,000~10억4,000만원(모형 1기준), 약 8억2,300~10억4,400(모형 2기준)만원 감소한 것으로 추정됐다.
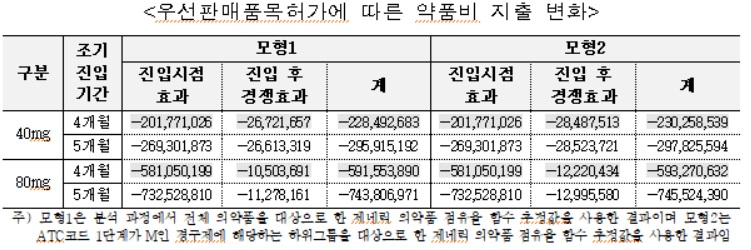
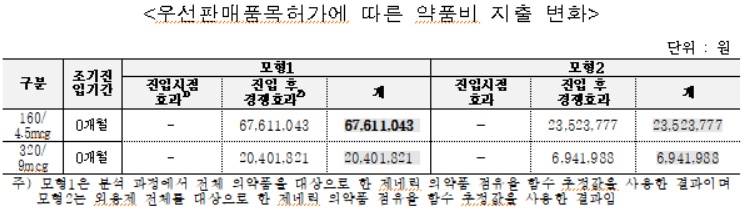
심비코트터부헬러 후발의약품의 약품비 지출은 약 8,800만원(모형 1기준), 약 3,100만원(모형 2기준) 증가한 것으로 추정됐다.
아모잘탄정 후발의약품의 경우 우선판매품목허가에 따른 조기 진입으로 오리지널 제약사의 매출은 조기진입 기간에 따라 약 9억3,100~11억6,600만원(모형 1기준), 약 6억5,100~11억6,600만원(모형 2기준) 감소가 추정됐다. 제네릭 제약사의 매출은 조기진입 기간에 따라 약 8억3,700~10억4,700만원(모형 1기준), 약 5억8,500~10억4,700만원(모형 2기준) 증가가 추정됐다.
스타레보필름코팅정 후발의약품의 경우 우선판매품목허가에 따른 조기 진입으로 오리지널 제약사의 매출은 조기진입 기간에 따라 모형 약 2억2,500~2억9,000만원(1기준 ), 약 2억5,800~3억2,300만원(모형 2기준) 감소 추정됐다. 제네릭 제약사의 매출은 조기진입 기간에 따라 약 2억~2억5,700만원(모형 1기준), 약 2억3,100~2억8,800만원(모형 2기준) 증가 추정됐다.
페브릭정 후발의약품의 경우 우선판매품목허가에 따른 조기 진입으로 오리지널 제약사의 매출은 조기진입 기간에 따라 약 12억2,100~15억원(모형 1기준), 약 12억5,600~15억3,500만원(모형 2기준) 감소 추정됐다. 제네릭 제약사의 매출은 조기진입 기간에 따라 약 4억200~4억6,000만원(모형 1기준), 약 4억3,200~4억9,200만원(모형 2기준) 증가 추정됐다.
심비코트터부헬러 후발의약품의 경우 오리지널 제약사의 매출은 약 5억7,000만원(모형 1기준), 약 2억2,100만원(모형 2기준) 증가 추정됐다. 제네릭 제약사의 매출은 조기진입 기간에 따라 약 4억8,200만원(모형 1기준), 약 1억9,100만원(모형 2기준) 감소 추정됐다.
간접영향= 간접영향은 직접영향에서 분석한 제약사 매출액 추정 결과를 토대로 그로 인한 제약기업의 연구개발비와 고용변화를 추정했다.
평가 결과, 제네릭사의 연구개발비는 판매금지로 인해 약 400~1,600만원 감소, 우선판매품목허가로 인해 약 6,800~1억1,600만원 증가한 것으로 나타났다.
오리지널사의 연구개발비는 판매금지로 약 1,700~4,200만원 증가, 우선판매품목허가로 약 1억2,800~1억9,900만원 감소했다.
제약기업 심층면담 및 설문조사 결과에 의하면 허가특허연계제도로 인해 제네릭 의약품 연구개발 및 생산에 필요한 특허 도전 비용이 증가했으나, 연구개발에 대한 투자 자체에는 큰 영향을 주지 않은 것으로 나타났다.
제네릭사의 고용 변화는 판매금지로 약 0.36~1.3명 감소, 우선판매품목허가로 약 5.7~9.7명 증가했다. 오리지널사의 고용 변화는 판매금지로 약 1.4~3.5명 증가, 우선판매품목허가로 약 10.7~16.6명 감소했다.
이는 제약사 내부인력 고용에는 눈에 띄는 변화가 없으나 특허관련 업무처리를 위해 외부 자문 활용 증가한 것으로 보이며, 제약기업 설문조사 결과에 의하면 인력 증원 31.2%(10건), 변화 없음59.4%(19건)로 자체 내부인력에 변화 없다는 응답의 비율이 더 높게 나타났다.
설문조사 및 심층 인터뷰= 설문조사는 한국제약바이오협회, 한국글로벌의약산업협회 회원사 총 32개 제약기업(국내 21곳, 다국적 11곳)을 대상으로, 심층 인터뷰는 총 11개 기업(국내 8곳, 다국적 3곳)을 대상으로 진행했다.
설문 및 인터뷰 결과, 특허권등재는 후발의약품으로부터 통지를 받는 사실을 중요하게 생각해 등재요건을 충족하는 특허 대부분을 등 등재했다.
판매금지의 경우, 오리지널사의 경우 판매금지 신청에 드는 비용, 판매금지기간 등을 고려하면 판매금지의 실익이 크지 않다고 판단했다.
우선판매품목허가는 제도 시행 전에 비해 제네릭의약품 개발 검토시기를 앞당긴 측면은 있으나 하나의 등재의약품에 다수 기업이 우선판매품목허가를 받는 등 실제 기업 매출에 미친 영향은 미미하다고 답했다. 단, 특허 관련 업무 처리를 위한 외부자문 활용은 증가했다.
연구개발 등에서는 허가특허연계제도가 연구개발 투자나 인력 규모에 큰 영향을 미치지 않다는 응답을 확인했다.
[관련기사]
의약품 허가특허연계제도 전격 시행
2015-03-13 09:35
오늘의 헤드라인
전체댓글 0개
등록된 댓글이 없습니다.
| 인기기사 | 더보기 + |
-
1 상장 제약바이오 3Q 누적 평균 R&D비...전년비 코스피 7.0%, 코스닥 9.1%↑ -
2 에이비프로,셀트리온과 HER2 양성암 치료제 미국 FDA IND 제출 -
3 의약외품을 발톱무좀 치료제로?…대한약사회, 과장광고 ‘경보’ -
4 오스코텍, 사노피에 1.5조 규모 기술이전 성공…타우 타깃 신약후보 'ADEL -Y01' -
5 “규제의 속도가 산업의 속도”…식약처, 인력·AI·현장으로 답하다 -
6 보건복지부, '바이오·돌봄'에 올인... 5년 만에 대대적 조직 개편 -
7 “한국은 북아시아 혁신 전략 핵심 시장…환자 접근성 개선이 가장 중요한 과제” -
8 신테카바이오, 파노로스바이오에 '다중표적 항체 5종' 기술이전 성공 -
9 무약촌 앞세운 안전상비약 확대 기류에…약사회는 ‘원칙대로’ -
10 "마약 원료 감기약을 쇼핑하듯?"... 약사회, 창고형 약국 '슈도에페드린' 대량 판매에 강력 경고
| 인터뷰 | 더보기 + |
| PEOPLE | 더보기 + |
| 컬쳐/클래시그널 | 더보기 + |

허가특허연계제도 2년, 제네릭사 매출 9~14억원↑
오리지널사 매출 16~22억원↓…약품비는 7~9억원↓
식약처 "국내 제약산업·보건정책에 미치는 영향 적은 편"
식약처 "국내 제약산업·보건정책에 미치는 영향 적은 편"
- 이승덕 기자 duck4775@yakup.com
- 입력 2017.12.29 06:00 수정 2017.12.29 06:41
허가특허연계제도 시행 이후 2년 간 제네릭사의 매출이 약 9~14억 정도 증가하고, 오리지널사가 16~22억 가량 감소됐다고 측정된 가운데, 국내에 미치는 영향이 크지 않은 것으로 평가됐다.

이번 연구는 서울대 산학협력단(연구책임자 이태진 교수)이 허가특허연계제도 시행 후 2년간(2015년 3월~2017년 3월) 제약산업 등에 미치는 영향을 산출, 직접영향, 간접영향 등 3개 영역으로 구분·평가했다.
평가 주요 결과를 보면, 판매금지 기간은 1.4~1.7개월 정도로 지연됐고, 우선판매로 인해서는 4.6~8.2개월 조기진입했다. 약품비는 약 7~8억원 감소(판매금지 1.8~3.6억↑, 우선판매 9.4~12.8억↓)했다.
제네릭사 매출은 약 9~14억원 증가(판매금지 0.6~2.2억↓, 우선판매 10~16억↑)했으며, 오리지널사 매출은 약 16~22억원 감소(판매금지 2.4~5.9억↑, 우선판매 18~28억↓)했다.
이에 대해 식약처는 "제도 도입 시 오리지널사의 판매금지조치로 인한 제네릭의약품의 시장진입지연, 그로 인한 건강보험 약품비 증가 및 제약기업매출 감소 등 부정적 영향에 대한 우려가 많았으나, 국내 제약산업·보건정책에 미치는 영향은 크지 않은 것으로"고 설명했다.
이어 "오리지널사의 판매금지 신청건수가 많지 않았고, 우선판매품목허가제도의 영향으로 제네릭의약품의 시장진입이 다소 앞당겨진 것으로 분석된다"며 "그 결과 판매금지, 우선판매품목허가 등 허가특허연계제도 시행에 따른 약품비 및 제약사 매출변화는 매우 낮은 수준으로 평가된다"고 부연했다.
다만 "현재 제도 시행 초기로 영향평가를 위한 분석 대상·기간이 충분하지 않은 점을 고려할 때 중장기적으로 지속 검토·분석할 필요가 있다"고 여지를 두기도 했다.

직접영향[판매금지]= 평가대상 의약품은 평가기간 중 판매금지가 종료(효력 소멸, 기간 만료)된 21개 품목으로, 통풍치료제인 페브릭정 2개 품목(40mg, 80mg) 관련 판매금지처분을 받은 후발의약품 19개 품목(40mg 9개, 80mg 10개)과 과민성방광증 치료제인 베시케어정 2개 품목(5mg, 10mg) 관련 판매금지처분을 받은 후발의약품 2개 품목(5mg 1개, 10mg 1개)이다.
페브릭정 후발의약품의 실제 판매금지기간은 평균 42일(1.4개월)로 법령상 가능한 최대 판매금지기간(통지수령일로부터 9개월) 보다 단축됐다.
베시케어정 후발의약품의 실제 판매금지기간은 평균 50일(1.7개월)로 법령상 가능한 최대 판매금지기간(통지수령일로부터 9개월)보다 단축됐다.
페브릭정 후발의약품의 약품비 지출은 판매금지에 따른 시장 진입 지연으로 실제 판매금지기간에 따라 약 1억7,700∼3억4,200만원(모형 1기준), 약 1억7,700∼3억4,100만원(모형 2기준) 증가한 것으로 추정됐다.

베시케어정 후발의약품의 약품비 지출은 판매금지에 따른 시장 진입 지연으로 실제 판매금지기간에 따라 약 900∼2,100만원(모형 1기준), 약 600∼1,600만원(모형 2기준) 증가한 것으로 추정됐다.

페브릭정 후발의약품의 판매금지에 따른 시장 진입 지연으로 판매금지가 없었을 경우에 비해 오리지널 제약사의 매출은 실제판매금지기간에 따라 약 1억9,300∼3억7,900원(모형 1기준), 약 1억8,600~3억6,600만원 증가(모형 2기준)가 추정됐다.
제네릭 제약사의 매출은 실제판매금지기간에 따라 약 1,600∼3,700만원(모형 1기준), 약 900~2,300만원(모형 2기준) 감소가 추정됐다.

베시케어정 후발의약품의 경우 판매금지에 따른 시장 진입 지연으로 판매금지가 없었을 경우에 비해, 오리지널 제약사의 매출은 실제판매금지기간에 따라 약 8,500∼2억800만원(모형 1기준), 약 5,700~1억6,100만원(모형 2기준) 증가가 추정됐다.
제네릭 제약사의 매출은 실제판매금지기간에 따라 약 7,600∼1억8,700만원(모형 1기준), 약 5,100~1억4,500만원(모형 2기준) 감소가 추정됐다.

시장점유율 분석 결과에서는 평가대상의약품 모두 제네릭 의약품 시장점유율 추정값에 비해 다소 높거나 비슷한 점유율을 보였다.
직접영향[우선판매품목허가]= 평가대상 의약품은 평가기간에 우선판매품목허가가 종료된 75개 품목이다.
구체적으로는 아모잘탄정 3개 품목(5/100mg, 5/50mg, 10/50mg)에 대해 우선판매품목허가를 받은 후발의약품 45개 품목(5/100mg 16개, 5/50mg 20개, 10/50mg 9개)과 스타레보필름코팅정 4개 품목(50/12.5/200mg, 75/18.75/200mg, 100/25/200mg, 125/31.25/200mg)에 대해 우선판매품목허가를 받은 후발의약품 11개 품목(50/12.5/200mg 3개, 75/18.75/200mg 3개, 100/25/200mg 2개, 125/31.25/200mg 3개), 페브릭정 2개 품목(40mg, 80mg)에 대해 우선판매품목허가를 받은 후발의약품 17개 품목(40mg 9개, 80mg 8개), 심비코트터부헬러 2개 품목(160/4.5mcg, 320/9mcg)에 대해 우선판매품목허가를 받은 후발의약품 2개 품목이다.
분석 결과, 아모잘탄정 후발의약품은 우선판매품목허가를 획득하지 못했을 경우에 비해 약 8.2개월 조기 진입한 것으로 나타났고, 스타레보필름코팅정 후발의약품은 약 4.6~8개월 조기 진입한 것으로 나타났다.
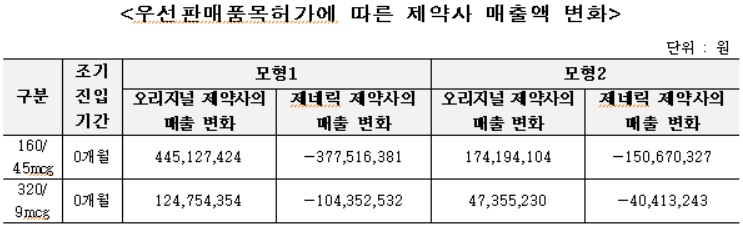
페브릭정 후발의약품은 약 4.6개월 조기 진입했고, 심비코트터부헬러 후발의약품은 0개월 조기 진입한 것으로 나타났다.
아모잘탄정, 심비코트터부헬러 후발의약품의 경우 제네릭 의약품 시장점유율 추정값에 비해 낮음, 페브릭정 후발의약품은 다소 높음으로 나타났다. 스타레보필름코팅정 후발의약품의 경우 진입초기 낮은 점유율을 보이다 13개월 시점 이후 제네릭 의약품 시장점유율 추정값 보다 높은 점유율을 보였다.
아모잘탄정 후발의약품의 약품비 지출은 조기진입 기간에 따라 약 9,500~1억1,900만원(모형 1기준), 약 6,600~1억1,900만원(모형 2기준) 감소한 것으로 추정됐다.

스타레보필름코팅정 후발의약품의 약품비 지출은 조기진입 기간에 따라 약 2,500~3,100(모형 1기준), 약 2,700~3,500만원(모형 2기준) 감소한 것으로 추정됐다.

페브릭정 후발의약품의 약품비 지출은 조기진입 기간에 따라 약 8억2,000~10억4,000만원(모형 1기준), 약 8억2,300~10억4,400(모형 2기준)만원 감소한 것으로 추정됐다.

심비코트터부헬러 후발의약품의 약품비 지출은 약 8,800만원(모형 1기준), 약 3,100만원(모형 2기준) 증가한 것으로 추정됐다.

아모잘탄정 후발의약품의 경우 우선판매품목허가에 따른 조기 진입으로 오리지널 제약사의 매출은 조기진입 기간에 따라 약 9억3,100~11억6,600만원(모형 1기준), 약 6억5,100~11억6,600만원(모형 2기준) 감소가 추정됐다. 제네릭 제약사의 매출은 조기진입 기간에 따라 약 8억3,700~10억4,700만원(모형 1기준), 약 5억8,500~10억4,700만원(모형 2기준) 증가가 추정됐다.

스타레보필름코팅정 후발의약품의 경우 우선판매품목허가에 따른 조기 진입으로 오리지널 제약사의 매출은 조기진입 기간에 따라 모형 약 2억2,500~2억9,000만원(1기준 ), 약 2억5,800~3억2,300만원(모형 2기준) 감소 추정됐다. 제네릭 제약사의 매출은 조기진입 기간에 따라 약 2억~2억5,700만원(모형 1기준), 약 2억3,100~2억8,800만원(모형 2기준) 증가 추정됐다.

페브릭정 후발의약품의 경우 우선판매품목허가에 따른 조기 진입으로 오리지널 제약사의 매출은 조기진입 기간에 따라 약 12억2,100~15억원(모형 1기준), 약 12억5,600~15억3,500만원(모형 2기준) 감소 추정됐다. 제네릭 제약사의 매출은 조기진입 기간에 따라 약 4억200~4억6,000만원(모형 1기준), 약 4억3,200~4억9,200만원(모형 2기준) 증가 추정됐다.

심비코트터부헬러 후발의약품의 경우 오리지널 제약사의 매출은 약 5억7,000만원(모형 1기준), 약 2억2,100만원(모형 2기준) 증가 추정됐다. 제네릭 제약사의 매출은 조기진입 기간에 따라 약 4억8,200만원(모형 1기준), 약 1억9,100만원(모형 2기준) 감소 추정됐다.

간접영향= 간접영향은 직접영향에서 분석한 제약사 매출액 추정 결과를 토대로 그로 인한 제약기업의 연구개발비와 고용변화를 추정했다.
평가 결과, 제네릭사의 연구개발비는 판매금지로 인해 약 400~1,600만원 감소, 우선판매품목허가로 인해 약 6,800~1억1,600만원 증가한 것으로 나타났다.
오리지널사의 연구개발비는 판매금지로 약 1,700~4,200만원 증가, 우선판매품목허가로 약 1억2,800~1억9,900만원 감소했다.
제약기업 심층면담 및 설문조사 결과에 의하면 허가특허연계제도로 인해 제네릭 의약품 연구개발 및 생산에 필요한 특허 도전 비용이 증가했으나, 연구개발에 대한 투자 자체에는 큰 영향을 주지 않은 것으로 나타났다.
제네릭사의 고용 변화는 판매금지로 약 0.36~1.3명 감소, 우선판매품목허가로 약 5.7~9.7명 증가했다. 오리지널사의 고용 변화는 판매금지로 약 1.4~3.5명 증가, 우선판매품목허가로 약 10.7~16.6명 감소했다.
이는 제약사 내부인력 고용에는 눈에 띄는 변화가 없으나 특허관련 업무처리를 위해 외부 자문 활용 증가한 것으로 보이며, 제약기업 설문조사 결과에 의하면 인력 증원 31.2%(10건), 변화 없음59.4%(19건)로 자체 내부인력에 변화 없다는 응답의 비율이 더 높게 나타났다.
설문조사 및 심층 인터뷰= 설문조사는 한국제약바이오협회, 한국글로벌의약산업협회 회원사 총 32개 제약기업(국내 21곳, 다국적 11곳)을 대상으로, 심층 인터뷰는 총 11개 기업(국내 8곳, 다국적 3곳)을 대상으로 진행했다.
설문 및 인터뷰 결과, 특허권등재는 후발의약품으로부터 통지를 받는 사실을 중요하게 생각해 등재요건을 충족하는 특허 대부분을 등 등재했다.
판매금지의 경우, 오리지널사의 경우 판매금지 신청에 드는 비용, 판매금지기간 등을 고려하면 판매금지의 실익이 크지 않다고 판단했다.
우선판매품목허가는 제도 시행 전에 비해 제네릭의약품 개발 검토시기를 앞당긴 측면은 있으나 하나의 등재의약품에 다수 기업이 우선판매품목허가를 받는 등 실제 기업 매출에 미친 영향은 미미하다고 답했다. 단, 특허 관련 업무 처리를 위한 외부자문 활용은 증가했다.
연구개발 등에서는 허가특허연계제도가 연구개발 투자나 인력 규모에 큰 영향을 미치지 않다는 응답을 확인했다.
Copyright © Yakup.com All rights reserved.
약업신문 의 모든 컨텐츠(기사)는 저작권법의 보호를 받습니다.
무단 전재·복사·배포 등을 금지합니다.
무단 전재·복사·배포 등을 금지합니다.



 기자가 쓴 기사 더보기
기자가 쓴 기사 더보기
