 기자가 쓴 기사 더보기
기자가 쓴 기사 더보기
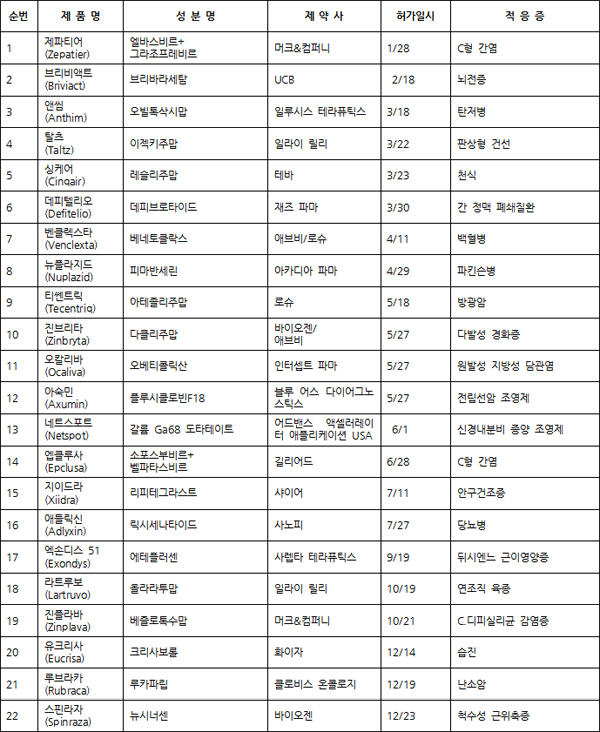
신규조성물(NMEs) 신약 및 신규 생물의약품을 포함해 총 22개(12월 28일 현재 기준)의 신약들이 2016년 한해 동안 FDA의 허가관문을 통과한 것으로 나타났다.
FDA 약물평가연구센터(CDER)의 신규조성물 신약 및 신규 생물의약품 허가현황 자료에 따르면 지난 23일 최초의 척수성 근위축증 치료제로 허가를 취득한 바이오젠社의 ‘스핀라자’(Spinraza: 뉴시너센)까지 포함하더라도 전체 승인건수가 지난해의 45개에 미치지 못한 것으로 분석됐다.
참고로 지난해에는 희귀질환 치료제만도 전체 허가취득 신약의 절반에 육박하는 21개에 달하면서 47%를 점유한 것으로 집계됐었다. 그렇다면 전체 신약 허가건수가 지금까지 가장 많은 수의 새로운 희귀질환 치료제들이 FDA로부터 승인받은 해로 기록된 2015년의 21개와 앞‧뒷집 차이를 내보이는 데 그친 셈이다.
당초 애널리스트들은 올해 총 25개의 신규조성물 신약 및 생물의약품 신약들이 FDA의 허가를 취득할 수 있을 것으로 예상해 왔다.
하지만 이 수치는 12월 중으로 허가취득이 기대되었던 로슈社의 다발성 경화증 치료제 ‘오크레버스’(Ocrevus: 오크렐리주맙)과 셈프라社(Cempra)의 마크로라이드 계열 항균제 ‘솔리테라’(Solithera: 솔리스로마이신)까지 포함한 것이다.
‘오크레버스’는 지난 20일 FDA가 검토기간을 3개월 연장키로 했으며, ‘솔리테라’는 29일 FDA로부터 “불허한다”를 통보받았다.
이 중 ‘오크레버스’는 2016년 최대의 허가취득 사례가 될 수 있을 것이라는 전망까지 제기되면서 또 하나의 블록버스터 드럭 출현을 고대하케 했던 기대주이다.
또 다른 기대주였던 일라이 릴리社의 알쯔하이머 치료제 솔라네주맙(solanezumab)의 경우 지난달 개발이 실패로 귀결되면서 새삼 신약개발에 내재된 위험성을 환기시킨 바 있다.
이에 따라 설령 ‘오크레버스’와 ‘솔리테라’가 허가관문을 넘어섰더라도 2016년은 FDA의 허가를 취득한 신약들의 숫자가 크게 감소한 해로 기록되면서 최근 2년 동안 눈에 띄었던 연구‧개발 생산성 향상이 단지 일시적인 상황변화에 불과한 것이었을 수 있다는 관측에 무게가 실리게 할 것으로 보인다.
지난해의 경우 11월 말까지만 하더라도 총 40개의 신규조성물 신약들이 FDA로부터 발매를 승인받아 2014년 및 2013년의 기록을 조기에 훌쩍 뛰어넘은 바 있기 때문이다.
▉ 2016년 FDA 신약 허가현황
| 인기기사 | 더보기 + |
-
1 베일 벗은 에이비엘바이오 비장의 카드㊤ siRNA와 그랩바디-B -
2 아미코젠, 인도 대리점 Aruni 통해 IEX 레진 첫 상업용 수주 확보 -
3 베일 벗은 에이비엘바이오 비장의 카드㊦ siRNA가 ‘꿈의 기술’인 이유 -
4 "약가 인하, 도매 구조조정 신호탄"…유통 내부서 '단합론' 확산 -
5 아미코젠, 신규 인간 히알루로니다제 비임상 효능 확인 -
6 한국유나이티드제약, ‘개량신약 60%’ 정조준… “3300억 매출 달성 목표” -
7 아리바이오, 오스트리아 정부 지원 ‘전자약 GVD-01’ 국제 공동임상시험 착수 -
8 제약업계, 노동계 우군 확보… 약가 개편 대정부 협상 '새 국면' -
9 아미코젠,, DCI 포함 동물세포 배양용 배지 조성물 국내·PCT 출원 -
10 미간ㆍ눈가주름 개선용 액제 FDA 허가심사 개시
| 인터뷰 | 더보기 + |
| PEOPLE | 더보기 + |
| 컬쳐/클래시그널 | 더보기 + |

- 이덕규 기자 abcd@yakup.com
- 입력 2016.12.30 11:32 수정 2016.12.30 14:06
신규조성물(NMEs) 신약 및 신규 생물의약품을 포함해 총 22개(12월 28일 현재 기준)의 신약들이 2016년 한해 동안 FDA의 허가관문을 통과한 것으로 나타났다.
FDA 약물평가연구센터(CDER)의 신규조성물 신약 및 신규 생물의약품 허가현황 자료에 따르면 지난 23일 최초의 척수성 근위축증 치료제로 허가를 취득한 바이오젠社의 ‘스핀라자’(Spinraza: 뉴시너센)까지 포함하더라도 전체 승인건수가 지난해의 45개에 미치지 못한 것으로 분석됐다.
참고로 지난해에는 희귀질환 치료제만도 전체 허가취득 신약의 절반에 육박하는 21개에 달하면서 47%를 점유한 것으로 집계됐었다. 그렇다면 전체 신약 허가건수가 지금까지 가장 많은 수의 새로운 희귀질환 치료제들이 FDA로부터 승인받은 해로 기록된 2015년의 21개와 앞‧뒷집 차이를 내보이는 데 그친 셈이다.
당초 애널리스트들은 올해 총 25개의 신규조성물 신약 및 생물의약품 신약들이 FDA의 허가를 취득할 수 있을 것으로 예상해 왔다.
하지만 이 수치는 12월 중으로 허가취득이 기대되었던 로슈社의 다발성 경화증 치료제 ‘오크레버스’(Ocrevus: 오크렐리주맙)과 셈프라社(Cempra)의 마크로라이드 계열 항균제 ‘솔리테라’(Solithera: 솔리스로마이신)까지 포함한 것이다.
‘오크레버스’는 지난 20일 FDA가 검토기간을 3개월 연장키로 했으며, ‘솔리테라’는 29일 FDA로부터 “불허한다”를 통보받았다.
이 중 ‘오크레버스’는 2016년 최대의 허가취득 사례가 될 수 있을 것이라는 전망까지 제기되면서 또 하나의 블록버스터 드럭 출현을 고대하케 했던 기대주이다.
또 다른 기대주였던 일라이 릴리社의 알쯔하이머 치료제 솔라네주맙(solanezumab)의 경우 지난달 개발이 실패로 귀결되면서 새삼 신약개발에 내재된 위험성을 환기시킨 바 있다.
이에 따라 설령 ‘오크레버스’와 ‘솔리테라’가 허가관문을 넘어섰더라도 2016년은 FDA의 허가를 취득한 신약들의 숫자가 크게 감소한 해로 기록되면서 최근 2년 동안 눈에 띄었던 연구‧개발 생산성 향상이 단지 일시적인 상황변화에 불과한 것이었을 수 있다는 관측에 무게가 실리게 할 것으로 보인다.
지난해의 경우 11월 말까지만 하더라도 총 40개의 신규조성물 신약들이 FDA로부터 발매를 승인받아 2014년 및 2013년의 기록을 조기에 훌쩍 뛰어넘은 바 있기 때문이다.
▉ 2016년 FDA 신약 허가현황

무단 전재·복사·배포 등을 금지합니다.



