식품의약품안전처(처장 정승)는 한·미 자유무역협정(FTA)에 따른 의약품허가특허연계제도가 3월 15일부터 시행된다고 밝혔다.
이번 제도의 원활한 시행을 위해 관련 '약사법', '약사법 시행령', '의약품 등의 안전에 관한 규칙'을 13일에 공포한다.
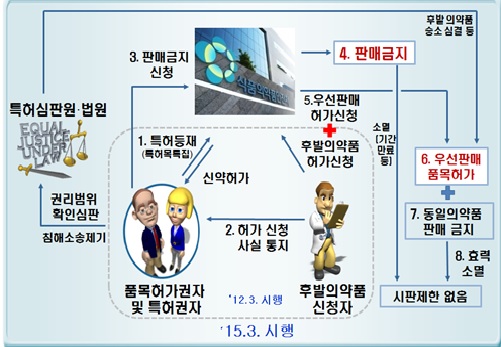
이번 법령의 주요 내용은 △의약품에 관한 특허권의 등재 및 특허권자에게 통지 제도의 개선 △특허 분쟁에 따른 판매금지조치의 마련 △우선판매품목허가제도의 신설 등이다.
의약품 품목허가를 받은 자가 의약품특허권을 등재하려는 경우 특허권자의 동의를 받도록 하는 내용이 신설됐으며, 허가일 전에 출원된 특허만을 등재할 수 있도록 됐다.
또한, 후발 의약품의 (허가)신청자가 특허권자에게 통지해야 하는 기간이 기존의 7일에서 20일로 늘어났다.
특허권자가 후발 의약품 (허가)신청자에게 특허 침해예방 청구 소송 등을 제기하고 식약처에 판매금지 신청을 하면 9개월간 후발 의약품의 판매가 금지된다.
다만, 후발 의약품 (허가)신청자가 특허권자의 등재된 특허를 침해하지 않았다는 것을 특허심판원·법원이 인정하면 후발 의약품 (허가)신청자는 ‘우선판매품목허가’를 통해 9개월간 해당 의약품을 우선 판매할 수 있다.
식약처는 이번 제도의 원활한 정착과 제약업계의 이해를 돕기 위해 △제도 개요 △기존 제도와 달라지는 사항 △새롭게 도입되는 제도 변화 △허가(신고)절차에서 달라지는 사항 등을 담은 ‘의약품 허가특허연계제도 안내서’도 홈페이지에 게재한다.
특히, 제약업계가 관심이 많은 △제도 적용 시점 △통지의무가 발생하는 변경허가신청 범위 등에 대해 상세히 안내한다.
제도 시행일인 3월 15일 이후 특허목록에 등재된 의약품의 자료를 이용한 허가 신청자부터 신설된 판매금지 및 우선판매품목허가제도의 적용을 받는다.
품목허가를 받은 자가 효능·효과 외의 사유로 의약품 허가사항을 변경하려는 경우에는 특허권자에게 통지하지 않아도 된다.
식약처는 이번 제도 시행과 더불어 의약품 특허권 보호와 함께 국내 후발 의약품의 균형적인 발전을 위해 노력하겠다고 밝혔다.
또한, 제도의 원활한 정착을 위해 설명회 등을 지속적으로 개최 하겠다고 설명했다.
자세한 내용은 홈페이지(www.mfds.go.kr) 법령자료에서 확인할 수 있다.
| 인기기사 | 더보기 + |
-
1 상장 제약바이오 3Q 누적 평균 R&D비...전년비 코스피 7.0%, 코스닥 9.1%↑ -
2 에이비프로,셀트리온과 HER2 양성암 치료제 미국 FDA IND 제출 -
3 오스코텍, 사노피에 1.5조 규모 기술이전 성공…타우 타깃 신약후보 'ADEL -Y01' -
4 의약외품을 발톱무좀 치료제로?…대한약사회, 과장광고 ‘경보’ -
5 “규제의 속도가 산업의 속도”…식약처, 인력·AI·현장으로 답하다 -
6 보건복지부, '바이오·돌봄'에 올인... 5년 만에 대대적 조직 개편 -
7 신테카바이오, 파노로스바이오에 '다중표적 항체 5종' 기술이전 성공 -
8 “한국은 북아시아 혁신 전략 핵심 시장…환자 접근성 개선이 가장 중요한 과제” -
9 무약촌 앞세운 안전상비약 확대 기류에…약사회는 ‘원칙대로’ -
10 "마약 원료 감기약을 쇼핑하듯?"... 약사회, 창고형 약국 '슈도에페드린' 대량 판매에 강력 경고
| 인터뷰 | 더보기 + |
| PEOPLE | 더보기 + |
| 컬쳐/클래시그널 | 더보기 + |

- 신은진 기자 ejshin@yakup.com
- 입력 2015.03.13 09:35 수정 2015.03.16 06:08

식품의약품안전처(처장 정승)는 한·미 자유무역협정(FTA)에 따른 의약품허가특허연계제도가 3월 15일부터 시행된다고 밝혔다.
이번 제도의 원활한 시행을 위해 관련 '약사법', '약사법 시행령', '의약품 등의 안전에 관한 규칙'을 13일에 공포한다.
이번 법령의 주요 내용은 △의약품에 관한 특허권의 등재 및 특허권자에게 통지 제도의 개선 △특허 분쟁에 따른 판매금지조치의 마련 △우선판매품목허가제도의 신설 등이다.
의약품 품목허가를 받은 자가 의약품특허권을 등재하려는 경우 특허권자의 동의를 받도록 하는 내용이 신설됐으며, 허가일 전에 출원된 특허만을 등재할 수 있도록 됐다.
또한, 후발 의약품의 (허가)신청자가 특허권자에게 통지해야 하는 기간이 기존의 7일에서 20일로 늘어났다.
특허권자가 후발 의약품 (허가)신청자에게 특허 침해예방 청구 소송 등을 제기하고 식약처에 판매금지 신청을 하면 9개월간 후발 의약품의 판매가 금지된다.
다만, 후발 의약품 (허가)신청자가 특허권자의 등재된 특허를 침해하지 않았다는 것을 특허심판원·법원이 인정하면 후발 의약품 (허가)신청자는 ‘우선판매품목허가’를 통해 9개월간 해당 의약품을 우선 판매할 수 있다.
식약처는 이번 제도의 원활한 정착과 제약업계의 이해를 돕기 위해 △제도 개요 △기존 제도와 달라지는 사항 △새롭게 도입되는 제도 변화 △허가(신고)절차에서 달라지는 사항 등을 담은 ‘의약품 허가특허연계제도 안내서’도 홈페이지에 게재한다.
특히, 제약업계가 관심이 많은 △제도 적용 시점 △통지의무가 발생하는 변경허가신청 범위 등에 대해 상세히 안내한다.
제도 시행일인 3월 15일 이후 특허목록에 등재된 의약품의 자료를 이용한 허가 신청자부터 신설된 판매금지 및 우선판매품목허가제도의 적용을 받는다.
품목허가를 받은 자가 효능·효과 외의 사유로 의약품 허가사항을 변경하려는 경우에는 특허권자에게 통지하지 않아도 된다.
식약처는 이번 제도 시행과 더불어 의약품 특허권 보호와 함께 국내 후발 의약품의 균형적인 발전을 위해 노력하겠다고 밝혔다.
또한, 제도의 원활한 정착을 위해 설명회 등을 지속적으로 개최 하겠다고 설명했다.
자세한 내용은 홈페이지(www.mfds.go.kr) 법령자료에서 확인할 수 있다.
무단 전재·복사·배포 등을 금지합니다.



 기자가 쓴 기사 더보기
기자가 쓴 기사 더보기
