이중항체 전문기업 에이비엘바이오(대표 이상훈)는 미국임상종양학회(American Society of Clinical Oncology, ASCO) 2024에서 진행된 ABL503(TJ-L14B, ragistomig)의 임상 1상 중간 데이터에 대한 포스터 발표를 성황리에 마무리했다고 4일 밝혔다.
ABL503 포스터는 6월 1일(현지시간) ASCO의 ‘Developmental Therapeutics Immunotherapy’ 세션에서 공개됐다.
ABL503은 글로벌 파트너사 아이맵 바이오파마(I-Mab Biopharma)와 공동 개발 중인 이중항체로, 면역 관문(Immune Checkpoint) 중 하나인 PD-L1과 면역 T 세포 활성화에 관여하는 4-1BB를 동시에 표적한다. ABL503에는 에이비엘바이오가 개발한 4-1BB 기반 이중항체 플랫폼 ‘그랩바디-T(Grabody-T)’가 적용됐다.
현재 미국과 한국에서 고형암 환자 대상 임상 1상이 진행 중이다. 차례로 투여 용량을 증가시키는 용량 증량(Dose Escalation) 파트는 미국에서, 용량 증량 파트를 통해 안전성이 확인된 특정 용량의 예비 항종양 활성을 평가하기 위한 용량 확장(Dose Expansion) 및 선정된 특정 암 종을 대상으로 진행되는 종양 확장(Tumor Expansion) 파트는 미국과 한국에서 진행되고 있다.
에이비엘바이오에 따르면 이번 중간 데이터 분석 대상이 된 환자들은 용량 증량 파트 참여자 34명과 용량 확장 파트에 참여한 19명으로, 총 53명이다. 이들 가운데 56.6%는 기존 PD-(L)1 억제제 치료에 반응하지 않거나 치료를 받은 후에도 암이 재발한 환자들이었으며, 환자들은 대부분 임상 참여 전 항암 치료 경험이 다수인 것으로 확인됐다.
전체 53명 중 효과 평가가 가능한 44명의 환자를 분석한 결과, ABL503의 임상 1상에서 1건의 완전관해(Complete Response, CR) 및 6건의 부분관해(Partial Response, PR)가 확인됐다. 이들 중 5명은 기존에 PD-(L)1 억제제 치료에 반응하지 않았거나 치료 후에도 암이 재발한 환자들이었다. 특히 CR의 경우, 사전 치료를 7회 이상 받고, PD-(L)1 억제제 치료 후 재발을 경험해 면역항암제 반응률이 매우 낮을 것으로 예상되는 난치 난소암 환자에서 나온 결과기에 더욱 의미가 있다는 게 회사 설명이다.
글로벌 바이오 기업 젠맵(Genmab)과 바이오엔텍(BioNTech)이 개발 중인 PD-L1 및 4-1BB 표적 이중항체 GEN1046이 임상 1상에서 4건의 PR만을 보고한 것을 고려할 때, 에이비엘바이오는 이번 성과를 매우 고무적인 것으로 평가하고 있다. GEN1046의 PR 환자 4명 중 기존 PD-(L)1 억제제 치료를 받은 환자는 2명뿐이다.
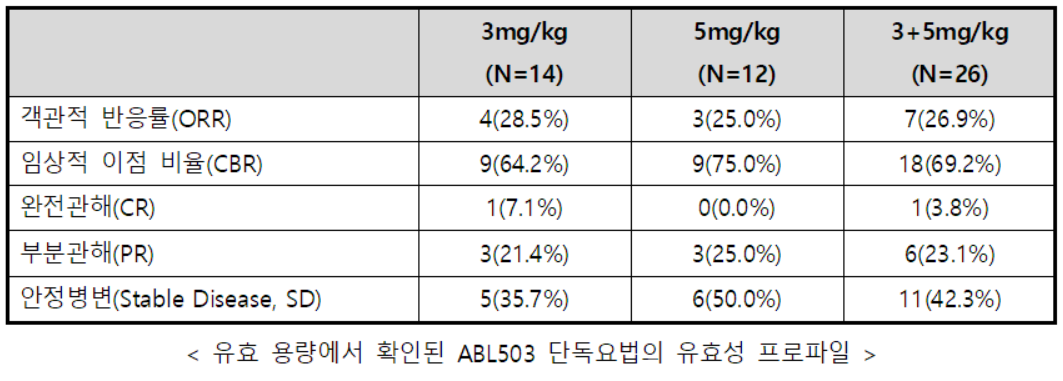
7명의 CR 및 PR 환자들은 모두 유효 용량인 3mg/kg과 5mg/kg을 투여받았으며, 이에 따라 유효 용량에서 확인된 ABL503의 객관적 반응률(Overall Response Rate, ORR)은 26.9%(7/26), 임상적 이점 비율(Clinical Benefit Rate, CBR)은 69.2%(18/26)로 나타났다. 또한, 바이오마커 분석 결과, CR 및 PR 환자에서 기억 T 세포(Memory T Cells)가 장기간 활성화되는 것으로 확인됐다고 회사는 덧붙였다.
안전성 측면에서도 관리 가능한 것으로 나타났다. 40명의 환자에서 최소 1건 이상의 치료 관련 부작용(Treatment-related Adverse Event, TRAE)이 보고됐다. 가장 흔한 TRAE는 알라닌 아미노기전달효소(Alanine Aminotransferase, ALT) 및 아스파트산 아미노기전달효소(Aspartate Aminotransferase, AST) 수치 증가였으며, Grade 3 이상의 ALTㆍAST 수치 상승을 보인 환자들은 스테로이드 치료 등으로 치료 가능했다.
또한 5명의 용량 제한 독성(Dose-Limiting Toxicity) 환자들 역시 모두 회복되었거나 회복 중인 것으로 확인됐으며, 최대 내약 용량(Maximum Tolerated Dose)은 7mg/kg이였다. 이에 따라, ABL503은 GEN1046 대비 치료용량범위(Therapeutic Window)가 4배 이상 높아 우수한 것으로 나타났다. 인히브릭스(Inhibrx), 메루스(Merus) 등 다른 경쟁사들은 저용량에서의 유효성을 확보하였으나, 부작용과 독성으로 인해 충분한 치료용량범위 확보에 실패하며 임상을 중단했다.
에이비엘바이오 이상훈 대표는 “250억 달러 매출의 글로벌 블록버스터 펨브롤리주맙을 비롯한 PD-(L)1 억제제는 다양한 암 종의 치료에 널리 사용되고 있지만, 이 치료에 반응해 효과를 보이는 환자는 20~30% 정도에 불과하다"면서 "이렇게 미충족 수요가 큰 상황 속에서 ABL503이 임상 1상임에도 PD-(L)1 억제제 치료에 반응하지 않거나 재발한 환자를 대상으로 CR과 PR이라는 우수한 성과를 보이고 있다”고 말했다.
이어 이 대표는 “ABL503으로 인한 AST 및 ALT 상승은 ABL503 뿐만 아니라 PD-(L)1을 표적하는 치료제들에서도 나타나는 것으로, 회복이 가능하다. 에이비엘바이오는 이번 중간 데이터와 현재 진행 중인 임상 1상에서 추가로 확인되는 결과들을 종합적으로 판단해 향후 임상 전략을 지속 고민해 나갈 계획”이라고 말했다.
| 인기기사 | 더보기 + |
-
1 [스페셜리포트] 에임드바이오, 연이은 기술수출 성공…ADC 신흥강자 부상 -
2 리가켐바이오, 오노약품서 ADC 플랫폼 기술이전 마일스톤 수령 -
3 비만 치료제 경쟁의 또 다른 전선…로슈, IP 관리에 1억 달러 투자 -
4 위더스제약, 정제 제형 제조업무 1개월 정지 -
5 아리바이오,JP모건 컨퍼런스서 경구 알츠하이머 치료제 빅딜 추진 -
6 올해 1위는?...의약품 ‘키트루다’-릴리, 비만약 타고 전문약 매출 ’접수‘ -
7 K-뷰티, 일본서도 색조는 부진…스킨케어만 강세 -
8 체질개선 감행 K-뷰티 '큰 형님들', 올해는 반등할까? -
9 지노믹트리 ‘얼리텍-B’,방광암 체외진단검사 3등급 제조허가 획득 -
10 "빛과 소리의 만남에 AI 더했다"...한계 뛰어넘는 '초정밀 진단'의 미래
| 인터뷰 | 더보기 + |
| PEOPLE | 더보기 + |
| 컬쳐/클래시그널 | 더보기 + |

- 권혁진 기자 hjkwon@yakup.com
- 입력 2024.06.04 11:50

이중항체 전문기업 에이비엘바이오(대표 이상훈)는 미국임상종양학회(American Society of Clinical Oncology, ASCO) 2024에서 진행된 ABL503(TJ-L14B, ragistomig)의 임상 1상 중간 데이터에 대한 포스터 발표를 성황리에 마무리했다고 4일 밝혔다.
ABL503 포스터는 6월 1일(현지시간) ASCO의 ‘Developmental Therapeutics Immunotherapy’ 세션에서 공개됐다.
ABL503은 글로벌 파트너사 아이맵 바이오파마(I-Mab Biopharma)와 공동 개발 중인 이중항체로, 면역 관문(Immune Checkpoint) 중 하나인 PD-L1과 면역 T 세포 활성화에 관여하는 4-1BB를 동시에 표적한다. ABL503에는 에이비엘바이오가 개발한 4-1BB 기반 이중항체 플랫폼 ‘그랩바디-T(Grabody-T)’가 적용됐다.
현재 미국과 한국에서 고형암 환자 대상 임상 1상이 진행 중이다. 차례로 투여 용량을 증가시키는 용량 증량(Dose Escalation) 파트는 미국에서, 용량 증량 파트를 통해 안전성이 확인된 특정 용량의 예비 항종양 활성을 평가하기 위한 용량 확장(Dose Expansion) 및 선정된 특정 암 종을 대상으로 진행되는 종양 확장(Tumor Expansion) 파트는 미국과 한국에서 진행되고 있다.
에이비엘바이오에 따르면 이번 중간 데이터 분석 대상이 된 환자들은 용량 증량 파트 참여자 34명과 용량 확장 파트에 참여한 19명으로, 총 53명이다. 이들 가운데 56.6%는 기존 PD-(L)1 억제제 치료에 반응하지 않거나 치료를 받은 후에도 암이 재발한 환자들이었으며, 환자들은 대부분 임상 참여 전 항암 치료 경험이 다수인 것으로 확인됐다.
전체 53명 중 효과 평가가 가능한 44명의 환자를 분석한 결과, ABL503의 임상 1상에서 1건의 완전관해(Complete Response, CR) 및 6건의 부분관해(Partial Response, PR)가 확인됐다. 이들 중 5명은 기존에 PD-(L)1 억제제 치료에 반응하지 않았거나 치료 후에도 암이 재발한 환자들이었다. 특히 CR의 경우, 사전 치료를 7회 이상 받고, PD-(L)1 억제제 치료 후 재발을 경험해 면역항암제 반응률이 매우 낮을 것으로 예상되는 난치 난소암 환자에서 나온 결과기에 더욱 의미가 있다는 게 회사 설명이다.
글로벌 바이오 기업 젠맵(Genmab)과 바이오엔텍(BioNTech)이 개발 중인 PD-L1 및 4-1BB 표적 이중항체 GEN1046이 임상 1상에서 4건의 PR만을 보고한 것을 고려할 때, 에이비엘바이오는 이번 성과를 매우 고무적인 것으로 평가하고 있다. GEN1046의 PR 환자 4명 중 기존 PD-(L)1 억제제 치료를 받은 환자는 2명뿐이다.
7명의 CR 및 PR 환자들은 모두 유효 용량인 3mg/kg과 5mg/kg을 투여받았으며, 이에 따라 유효 용량에서 확인된 ABL503의 객관적 반응률(Overall Response Rate, ORR)은 26.9%(7/26), 임상적 이점 비율(Clinical Benefit Rate, CBR)은 69.2%(18/26)로 나타났다. 또한, 바이오마커 분석 결과, CR 및 PR 환자에서 기억 T 세포(Memory T Cells)가 장기간 활성화되는 것으로 확인됐다고 회사는 덧붙였다.
안전성 측면에서도 관리 가능한 것으로 나타났다. 40명의 환자에서 최소 1건 이상의 치료 관련 부작용(Treatment-related Adverse Event, TRAE)이 보고됐다. 가장 흔한 TRAE는 알라닌 아미노기전달효소(Alanine Aminotransferase, ALT) 및 아스파트산 아미노기전달효소(Aspartate Aminotransferase, AST) 수치 증가였으며, Grade 3 이상의 ALTㆍAST 수치 상승을 보인 환자들은 스테로이드 치료 등으로 치료 가능했다.
또한 5명의 용량 제한 독성(Dose-Limiting Toxicity) 환자들 역시 모두 회복되었거나 회복 중인 것으로 확인됐으며, 최대 내약 용량(Maximum Tolerated Dose)은 7mg/kg이였다. 이에 따라, ABL503은 GEN1046 대비 치료용량범위(Therapeutic Window)가 4배 이상 높아 우수한 것으로 나타났다. 인히브릭스(Inhibrx), 메루스(Merus) 등 다른 경쟁사들은 저용량에서의 유효성을 확보하였으나, 부작용과 독성으로 인해 충분한 치료용량범위 확보에 실패하며 임상을 중단했다.
에이비엘바이오 이상훈 대표는 “250억 달러 매출의 글로벌 블록버스터 펨브롤리주맙을 비롯한 PD-(L)1 억제제는 다양한 암 종의 치료에 널리 사용되고 있지만, 이 치료에 반응해 효과를 보이는 환자는 20~30% 정도에 불과하다"면서 "이렇게 미충족 수요가 큰 상황 속에서 ABL503이 임상 1상임에도 PD-(L)1 억제제 치료에 반응하지 않거나 재발한 환자를 대상으로 CR과 PR이라는 우수한 성과를 보이고 있다”고 말했다.
이어 이 대표는 “ABL503으로 인한 AST 및 ALT 상승은 ABL503 뿐만 아니라 PD-(L)1을 표적하는 치료제들에서도 나타나는 것으로, 회복이 가능하다. 에이비엘바이오는 이번 중간 데이터와 현재 진행 중인 임상 1상에서 추가로 확인되는 결과들을 종합적으로 판단해 향후 임상 전략을 지속 고민해 나갈 계획”이라고 말했다.
무단 전재·복사·배포 등을 금지합니다.



 기자가 쓴 기사 더보기
기자가 쓴 기사 더보기
