올해도 바이오 항암제 개발 열풍이 이어질 전망이다. 2024년 첫 번째 달부터 항종양 타깃 바이오의약품의 IND(임상시험계획승인신청서)가 대거 승인됐다. 특히 혈액암보다 치료가 까다롭다고 평가받는 고형암 대상 임상시험 승인도 꾸준히 이어지고 있다.
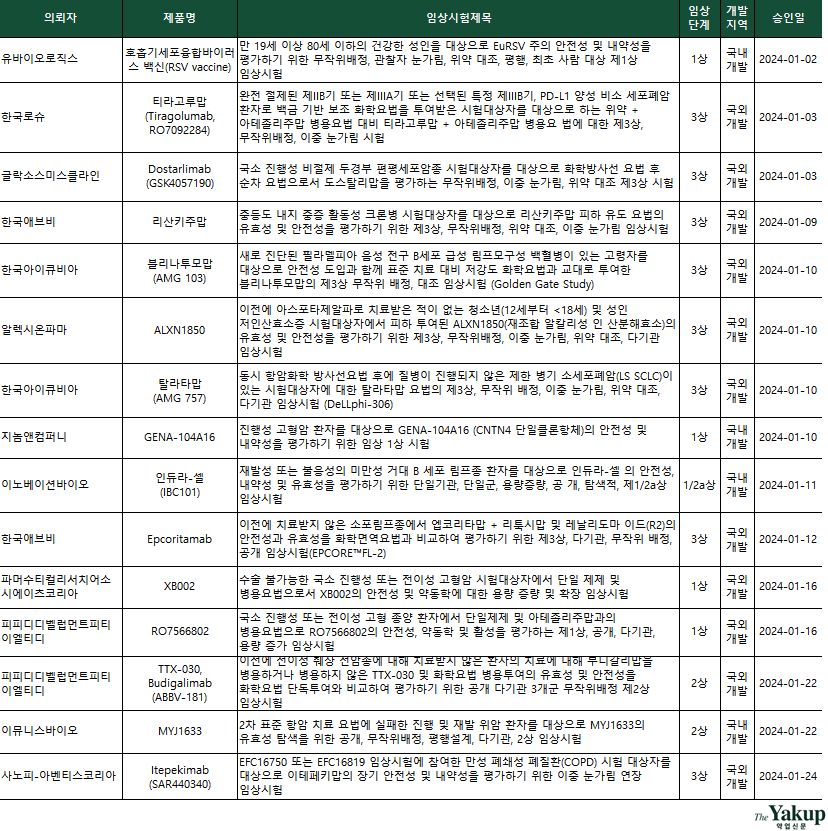
약업닷컴(약업신문)이 4일 한국바이오의약품협회 산업동향정보와 식약처 의약품통합정보시스템 자료를 분석한 결과, 지난 1월 한 달간(1일~31일) 바이오의약품 IND는 총 15건 승인됐다. 전체 승인된 IND 중 임상 3상이 8건으로 가장 많았고, 1상 5건(1/2a상 포함)과 2상 3건 순으로 집계됐다.
국내 기업은 유바이오로직스, 지놈앤컴퍼니, 이노베이션바이오, 이뮤니스바이오 총 4곳이 IND를 승인을 받았다. 이 중 이뮤니스바이오가 2상을, 이외는 1상을 승인받았다.
3상을 승인받은 기업은 △한국로슈 △글라소스미스클라인 △한국애브비 △한국아이큐비아 △알렉시온파마 △사노피 아벤티스 코리아 등 총 6개 기업이다. 이 중 한국아이큐비아와 한국애브비는 3상을 2건 씩을 승인받았다.
이달 항종양을 타깃하는 임상은 11건으로 전체 승인 IND 중 73%를 차지했다. 이 중 국내 기업 2곳에서도 항종양 임상에 돌입한다. 임상 후기 단계인 3상을 승인받은 5곳은 모두 국외 개발이다. 특히 이번 승인된 항종양 타깃 임상은 미충족 의료수요가 크고, 치료가 어려운 전이성 췌장 선암종, 소세포폐암 등 고형암 대상 임상이 많았다.
마이크로바이옴 신약개발 기업으로 널리 알려진 지놈앤컴퍼니가 면역항암 신약개발에 도전한다. 지놈앤컴퍼니는 진행성 고형암 환자를 대상으로 'GENA-104'의 안전성 및 내약성을 평가하기 위한 임상 1상을 승인받았다. 지놈앤컴퍼니는 GENA-104를 통해 계열 내 최초를 노리고 있다. GENA-104는 암세포에서 많이 발현하는 항원 'CNTN4'를 타깃한다. 현재 CNTN4을 타깃으로 상용화된 항암제는 없다. 개발에 성공하면 계열 내 최초 지위를 얻는다. 이는 경쟁 약물이 적은 신약후보물질을 선호하는 글로벌 빅파마들의 라이선스 거래 대상으로도 경쟁력을 가진다.
지놈앤컴퍼니 신약연구소 차미영 소장은 “CNTN4는 기존 항 PD-1(Programmed Death-1) 면역관문억제제에 효과가 작은 환자에게도 효과가 기대된다”면서 “실제 CNTN4 발현이 높은 위암 환자는 기존 항 PD-1(Programmed Death-1) 면역관문억제제에 대한 효과가 낮았다”고 밝혔다. 즉, 기존 면역관문억제제에 효과가 작은 환자에게 새로운 치료법을 제공할 수 있다는 것이다. 대표적인 항 PD-1 면역관문억제제는 MSD '키트루다'로, 지난해 매출만 250억 달러(약 33조 4625억원)로 집계됐다.
이뮤니스바이오도 위암 환자를 대상으로 NK면역세포치료제 'MYJ1633'의 임상 2상을 진행한다. 이뮤니스바이오는 2021년 4월 MYJ1633와 허셉틴(성분명: Trastuzumab)을 병용투여하는 1상을 승인받고, 환자 10명을 대상으로 임상시험을 진행해 왔다. 이번 2상은 말기 위암 환자를 대상으로 'MYJ1633'의 단독 유효성을 평가한다. 업계에선 이번 단독임상이 MYJ1633가 지난 병용임상에서 긍정적인 결과에 따른 것으로 내다보고 있다.
이 밖에 유바이오로직스가 호흡기세포융합바이러스 백신(RSV vaccine) 개발을 위한 1상을 승인받았다. 이노베이션바이오는 혈액암 종류인 미만성 거대 B 세포 림프종 치료제 '인듀라-셀(IBC101)'의 임상 1/2a상을 승인받았다.
| 인기기사 | 더보기 + |
-
1 한미약품그룹, 2137억 '빅딜'로 분쟁 종식… '전문경영인 패싱' 논란 딛고 R&D·내부결속 속도 -
2 비보존제약, 유증 103% 청약…경영진 참여 속 완판 -
3 FDA, 超희귀질환 맞춤 치료제 개발 더 빠르게.. -
4 “유전자치료제 실패 해결책 찾았다” 마크헬츠, AAV CDMO ‘MAAV-UP’ 출범 -
5 글로벌 제약사의 쓰라린 패배…2025 실패 임상 TOP 10 ② -
6 엘앤케이바이오, 글로벌 메이저사 전용 생산기지 ‘첫 삽’ -
7 유바이오로직스, 대상포진 백신 ‘EuHZV’ 1상 중간 결과 확보 -
8 알지노믹스 이성욱 대표- GC녹십자 이재우 전무 '바이오헬스 유공자' 포상 -
9 대웅제약,글로벌 비만 시장 정조준...‘마이크로니들’ 통증 없는 주사 전환 -
10 한국의료기기산업협회, '시험검사센터' 건립 승부수 띄웠다
| 인터뷰 | 더보기 + |
| PEOPLE | 더보기 + |
| 컬쳐/클래시그널 | 더보기 + |

- 권혁진 기자 hjkwon@yakup.com
- 입력 2024.02.05 06:00 수정 2024.07.08 19:18

올해도 바이오 항암제 개발 열풍이 이어질 전망이다. 2024년 첫 번째 달부터 항종양 타깃 바이오의약품의 IND(임상시험계획승인신청서)가 대거 승인됐다. 특히 혈액암보다 치료가 까다롭다고 평가받는 고형암 대상 임상시험 승인도 꾸준히 이어지고 있다.
약업닷컴(약업신문)이 4일 한국바이오의약품협회 산업동향정보와 식약처 의약품통합정보시스템 자료를 분석한 결과, 지난 1월 한 달간(1일~31일) 바이오의약품 IND는 총 15건 승인됐다. 전체 승인된 IND 중 임상 3상이 8건으로 가장 많았고, 1상 5건(1/2a상 포함)과 2상 3건 순으로 집계됐다.
국내 기업은 유바이오로직스, 지놈앤컴퍼니, 이노베이션바이오, 이뮤니스바이오 총 4곳이 IND를 승인을 받았다. 이 중 이뮤니스바이오가 2상을, 이외는 1상을 승인받았다.
3상을 승인받은 기업은 △한국로슈 △글라소스미스클라인 △한국애브비 △한국아이큐비아 △알렉시온파마 △사노피 아벤티스 코리아 등 총 6개 기업이다. 이 중 한국아이큐비아와 한국애브비는 3상을 2건 씩을 승인받았다.
이달 항종양을 타깃하는 임상은 11건으로 전체 승인 IND 중 73%를 차지했다. 이 중 국내 기업 2곳에서도 항종양 임상에 돌입한다. 임상 후기 단계인 3상을 승인받은 5곳은 모두 국외 개발이다. 특히 이번 승인된 항종양 타깃 임상은 미충족 의료수요가 크고, 치료가 어려운 전이성 췌장 선암종, 소세포폐암 등 고형암 대상 임상이 많았다.
마이크로바이옴 신약개발 기업으로 널리 알려진 지놈앤컴퍼니가 면역항암 신약개발에 도전한다. 지놈앤컴퍼니는 진행성 고형암 환자를 대상으로 'GENA-104'의 안전성 및 내약성을 평가하기 위한 임상 1상을 승인받았다. 지놈앤컴퍼니는 GENA-104를 통해 계열 내 최초를 노리고 있다. GENA-104는 암세포에서 많이 발현하는 항원 'CNTN4'를 타깃한다. 현재 CNTN4을 타깃으로 상용화된 항암제는 없다. 개발에 성공하면 계열 내 최초 지위를 얻는다. 이는 경쟁 약물이 적은 신약후보물질을 선호하는 글로벌 빅파마들의 라이선스 거래 대상으로도 경쟁력을 가진다.
지놈앤컴퍼니 신약연구소 차미영 소장은 “CNTN4는 기존 항 PD-1(Programmed Death-1) 면역관문억제제에 효과가 작은 환자에게도 효과가 기대된다”면서 “실제 CNTN4 발현이 높은 위암 환자는 기존 항 PD-1(Programmed Death-1) 면역관문억제제에 대한 효과가 낮았다”고 밝혔다. 즉, 기존 면역관문억제제에 효과가 작은 환자에게 새로운 치료법을 제공할 수 있다는 것이다. 대표적인 항 PD-1 면역관문억제제는 MSD '키트루다'로, 지난해 매출만 250억 달러(약 33조 4625억원)로 집계됐다.
이뮤니스바이오도 위암 환자를 대상으로 NK면역세포치료제 'MYJ1633'의 임상 2상을 진행한다. 이뮤니스바이오는 2021년 4월 MYJ1633와 허셉틴(성분명: Trastuzumab)을 병용투여하는 1상을 승인받고, 환자 10명을 대상으로 임상시험을 진행해 왔다. 이번 2상은 말기 위암 환자를 대상으로 'MYJ1633'의 단독 유효성을 평가한다. 업계에선 이번 단독임상이 MYJ1633가 지난 병용임상에서 긍정적인 결과에 따른 것으로 내다보고 있다.
이 밖에 유바이오로직스가 호흡기세포융합바이러스 백신(RSV vaccine) 개발을 위한 1상을 승인받았다. 이노베이션바이오는 혈액암 종류인 미만성 거대 B 세포 림프종 치료제 '인듀라-셀(IBC101)'의 임상 1/2a상을 승인받았다.

무단 전재·복사·배포 등을 금지합니다.



 기자가 쓴 기사 더보기
기자가 쓴 기사 더보기
