 기자가 쓴 기사 더보기
기자가 쓴 기사 더보기
이 때문에 많은 국내 제약사들이 문을 두드렸지만 쉽게 문을 열지 않으며 미국시장은 '난공불락'으로 여겨졌다.
하지만 최근 들어 이 같은 모습이 바뀌고 있다. 연구개발 노력이 성과를 거두며, 아직 많은 수는 아니지만 2013년을 기점으로 미국 FDA승인을 받는 제품수가 매년 빠르게 늘고 있다.
FDA승인과 진출 및 성공적인 판매는 별개의 문제지만, FDA승인을 받았다는 것은 그만큼 국내 제약바이오기업의 수준이 높아졌고, 국제적 위상도 높아졌다는 것을 의미한다는 점에서 매우 고무적이라는 분석이다.
미국 FDA 첫 승인은 2003년 이뤄졌다. LG생명과학(현 LG화학)의 항생제 ‘팩티브’가 2003년 첫 FDA 승인을 받은 이후 국내 제약사들은 FDA를 계속 노크했지만, 이렇다 할 성과를 내지 못했다. 두 번째는 10년 뒤에 나왔다.
2013년 한미약품의 역류성식도염치료제 ‘에소메졸’(미국 FDA로부터 시판허가를 받은 국내 최초 개량신약)이 국내 제약사 제품 중 두 번째로 FDA로부터 승인을 획득했다. 이후는 간격이 급격히 좁혀지고 있다.
이듬해인 2014년 동아ST가 항생제 ‘시벡스트로' 경구용과 주사제 두 품목에 대해 허가를 받았다.
2015년을 건너 뛴 후 2016년은 가장 많은 품목이 승인을 받았다.
셀트리온의 바이오시밀러 ‘램시마’(자가면역질환치료제), SK케미칼의 ‘앱스틸라’(혈우병치료제), 대웅제약의 ‘메로페넴’(항생제) 등 3제 품목이 FDA의 승인을 획득했다.
이 같은 상승세(?)는 올해(2017년)도 이어지며 삼성바이오로직스가 지난 4월 자가면역질환치료제 ‘레미케이드‘의 바이오시밀러 ’랜플렉시스‘에 대한 판매허가 승인(7월 판매 시작)을 받았고, 휴온스가 7월 0.9% 생리식염주사제 제네릭에 품목허가를 승인획득했다.
이외 셀트리온이 올해 5월, 6월 각각 유방암치료제 ‘허셉틴’(로슈)의 바이오시밀러 ‘허쥬마’와 혈액암 및 류마티스관절염치료제 ‘맙테라’(로슈)의 바이오시밀러 ‘트룩시마’에 대한 판매허가를 신청, 내년 승인을 기대하고 있다.
여기에 미국 임상에서 큰 진전을 보인 것으로 나타난 제품들이 속속 등장하고 있고, 이제는 해볼 만 하다고 판단하는 많은 제약바이오기업들이 미국시장 진출을 준비 중인 곳으로 파악되고 있어, 앞으로 미국시장 문은 지금보다 빠른 속도로 열릴 것이라는 전망이다.
한 상위 제약사 임원은 “ 미국시장은 세계 최대시장이고 성공적으로 진출하면 글로벌제약사에 다가설 수 있지만 불과 얼마전까지만 해도 ‘난공불락’으로 여겨졌다. 연구개발도 부족했고 제품도 없었기 때문이었다”며 “ 하지만 지금은 다르다. 부족한 점도 많지만 도전해볼만 하다는 자신감들이 있다. 지금과 같이 연구개발을 지속적으로 해 나가면 진출하는 제품들이 늘어날 것으로 본다”고 진단했다.
다른 상위 제약사 임원은 " 미국 FDA승인을 받고 들어간다고 무조건 성공을 담보하는 것은 아니지만 미국시장에 들어가지 않고 글로벌제약사가 되기는 사실상 힘들다"며 " 선진 다국적제약기업들이 국내 제약바이오기업의 기술력을 높게 평가하며 보는 눈이 달라지고 있고, 국내 기업들도 도전에 적극적이어서 앞으로 미국시장 진출은 빨라질 것"이라고 말했다.
미국 FDA 승인품목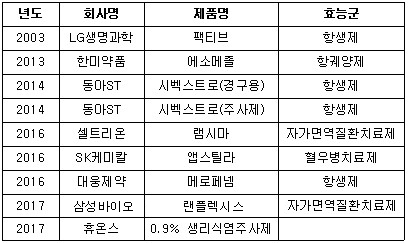
| 인기기사 | 더보기 + |
-
1 보로노이, 'VRN10' 임상 1상 데이터 공개..."초기 용량부터 항종양 효과 확인" -
2 화장품 기업 80개사 3Q 누적 해외매출 및 수출 평균 1157억…전년비 20.5%↑ -
3 11월 임상 키워드 ‘포트폴리오 재편’…셀트리온 확장, 종근당·동국제약 강화 -
4 '제약바이오산업 제조혁신'...스마트팩토리 고도화·CDMO 생태계 육성 '특명' -
5 "아리바이오 'AR1001', 알츠하이머 미충족 의료 수요 해결 혁신 경구치료제" -
6 "CDMO 특별법, '반쪽짜리' 안 되려면 R&D·품질 관리도 세제 지원해야" -
7 김태식 전 한국유나이티드제약 전무, 강남구 명예구민 선정 -
8 미국 남성 뷰티 공략 K-뷰티, 전신용·다기능·SNS 마케팅 주목해야 -
9 에이프로젠, 글로벌 파이프라인·CDMO 강화.. 바이오 도약 속도 -
10 북미시장 ‘아시안 뷰티’ 전도사 유통채널 ‘수코시’
| 인터뷰 | 더보기 + |
| PEOPLE | 더보기 + |
| 컬쳐/클래시그널 | 더보기 + |

- 이권구 기자 kwon9@yakup.com
- 입력 2017.08.07 06:30 수정 2017.08.07 12:53
이 때문에 많은 국내 제약사들이 문을 두드렸지만 쉽게 문을 열지 않으며 미국시장은 '난공불락'으로 여겨졌다.
하지만 최근 들어 이 같은 모습이 바뀌고 있다. 연구개발 노력이 성과를 거두며, 아직 많은 수는 아니지만 2013년을 기점으로 미국 FDA승인을 받는 제품수가 매년 빠르게 늘고 있다.
FDA승인과 진출 및 성공적인 판매는 별개의 문제지만, FDA승인을 받았다는 것은 그만큼 국내 제약바이오기업의 수준이 높아졌고, 국제적 위상도 높아졌다는 것을 의미한다는 점에서 매우 고무적이라는 분석이다.
미국 FDA 첫 승인은 2003년 이뤄졌다. LG생명과학(현 LG화학)의 항생제 ‘팩티브’가 2003년 첫 FDA 승인을 받은 이후 국내 제약사들은 FDA를 계속 노크했지만, 이렇다 할 성과를 내지 못했다. 두 번째는 10년 뒤에 나왔다.
2013년 한미약품의 역류성식도염치료제 ‘에소메졸’(미국 FDA로부터 시판허가를 받은 국내 최초 개량신약)이 국내 제약사 제품 중 두 번째로 FDA로부터 승인을 획득했다. 이후는 간격이 급격히 좁혀지고 있다.
이듬해인 2014년 동아ST가 항생제 ‘시벡스트로' 경구용과 주사제 두 품목에 대해 허가를 받았다.
2015년을 건너 뛴 후 2016년은 가장 많은 품목이 승인을 받았다.
셀트리온의 바이오시밀러 ‘램시마’(자가면역질환치료제), SK케미칼의 ‘앱스틸라’(혈우병치료제), 대웅제약의 ‘메로페넴’(항생제) 등 3제 품목이 FDA의 승인을 획득했다.
이 같은 상승세(?)는 올해(2017년)도 이어지며 삼성바이오로직스가 지난 4월 자가면역질환치료제 ‘레미케이드‘의 바이오시밀러 ’랜플렉시스‘에 대한 판매허가 승인(7월 판매 시작)을 받았고, 휴온스가 7월 0.9% 생리식염주사제 제네릭에 품목허가를 승인획득했다.
이외 셀트리온이 올해 5월, 6월 각각 유방암치료제 ‘허셉틴’(로슈)의 바이오시밀러 ‘허쥬마’와 혈액암 및 류마티스관절염치료제 ‘맙테라’(로슈)의 바이오시밀러 ‘트룩시마’에 대한 판매허가를 신청, 내년 승인을 기대하고 있다.
여기에 미국 임상에서 큰 진전을 보인 것으로 나타난 제품들이 속속 등장하고 있고, 이제는 해볼 만 하다고 판단하는 많은 제약바이오기업들이 미국시장 진출을 준비 중인 곳으로 파악되고 있어, 앞으로 미국시장 문은 지금보다 빠른 속도로 열릴 것이라는 전망이다.
한 상위 제약사 임원은 “ 미국시장은 세계 최대시장이고 성공적으로 진출하면 글로벌제약사에 다가설 수 있지만 불과 얼마전까지만 해도 ‘난공불락’으로 여겨졌다. 연구개발도 부족했고 제품도 없었기 때문이었다”며 “ 하지만 지금은 다르다. 부족한 점도 많지만 도전해볼만 하다는 자신감들이 있다. 지금과 같이 연구개발을 지속적으로 해 나가면 진출하는 제품들이 늘어날 것으로 본다”고 진단했다.
다른 상위 제약사 임원은 " 미국 FDA승인을 받고 들어간다고 무조건 성공을 담보하는 것은 아니지만 미국시장에 들어가지 않고 글로벌제약사가 되기는 사실상 힘들다"며 " 선진 다국적제약기업들이 국내 제약바이오기업의 기술력을 높게 평가하며 보는 눈이 달라지고 있고, 국내 기업들도 도전에 적극적이어서 앞으로 미국시장 진출은 빨라질 것"이라고 말했다.
미국 FDA 승인품목
무단 전재·복사·배포 등을 금지합니다.



