복지부, '경제적 이익 지출보고서' 양식 공식 공개
다음주 입법예고…현장의견 추가수렴 할 것
입력 2017.03.15 15:37
수정 2017.03.15 17:41

복지부는 15일 '경제적 이익 지출보고서 작성 의무화 제도 설명회'를 개최하고 보고서 작성양식과 세부내용에 대해 설명했다.
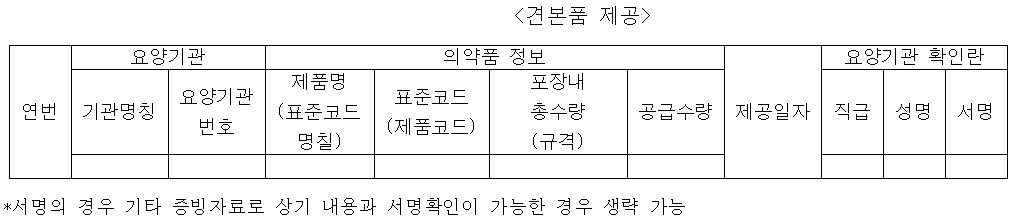
제약협회와 의협 등의 의견을 수렴해 수정·공개된 보고서양식은 당초 알려진 초안에 비해 관련 업계의 편의성을 고려한 조항들이 추가됐다. 견본품 제공, 임상시험 지원 등의 항목시 반드시 포함되어야 하는 의료인 서명을 기타 증빙자료로 확인가능하다면 생략가능하도록 한 것이다.
다만 최종안은 서명과 서명을 갈음할 수 있는 항목은 반드시 필요한 부분이라고 강조했다. 경제적 이익 지출보고서는 기업이 사적으로 관리하는 정보가 아닌 정부제출 보고서로써, 해당정보가 작성되지 않거나 허위기재된 경우 형사처벌이 이뤄질 수도 있기에 정보 기록자와 대상자의 쌍방 기록 차원에서 서명이 필요하다는 설명이다.
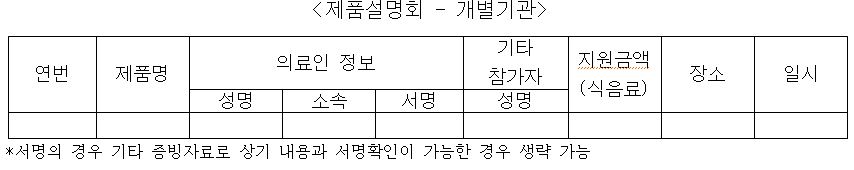
지출보고서 항목은 △견본품 제공 △임상시험 지원 △시판 후 조사 △제품설명회(복수/개별기관) △학술대회 지원 △대금결제 조건에 따른 비용할인으로 구성되어있다.
세부 항목은 다음과 같다.
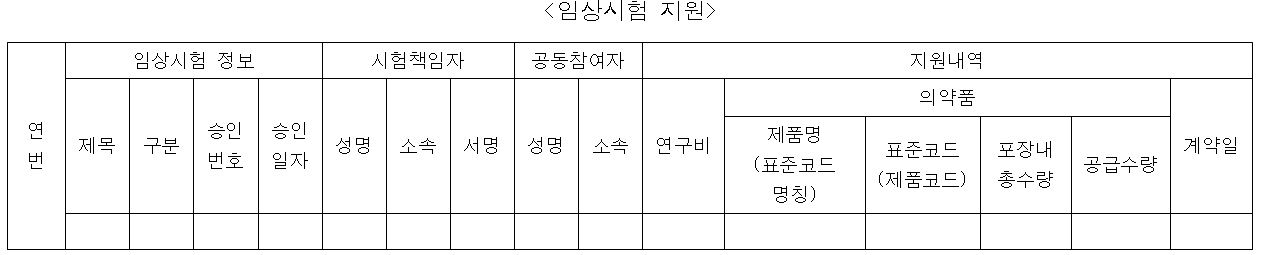

임상시험 지원 양식의 경우 임상시험의 제목을 기재하는 방안에 대한 건의가 이뤄졌으나, 복지부는 경제적 이익 지출보고서의 작성 주체는 각각의 제약사이고 열람 주체는 복지부이기에 경쟁제약사가 열람할 우려가 없고 해당 정보는 이미 식약처에서 공개정보로 분류하고 있어 문제가 없다고 밝혔다.




학술대회 지원의 경우 실질적인 제공내역 확인이 가능한 수준으로 항목을 정했다는 설명이다. 다만 학회 특성상 직급 항목과 서명을 대체할 수 있는 증빙자료를 무엇으로 할 지에 대한 논의는 진행중이라고 밝혔다.

박재우 복지부 약무정책과 사무관은 "그간 정부의 정책이 단순히 메뉴얼로 지시하는 방식이었기에 이번에는 시행전 관계자들에게 직접 정부가 설명하는 것이 필요하다고 판단해 설명회를 진행하게 됐다"며 "오늘 공개한 양식은 아직 공식적으로 확정되지 않은 초안으로 다음주 입법예고를 통해 현장의견수렴을 진행, 최종안을 확정할 것이다"고 말했다.
오늘의 헤드라인
전체댓글 0개
등록된 댓글이 없습니다.
| 인기기사 | 더보기 + |
-
1 "경구 치매약 'AR1001' 글로벌 임상3상 막바지..80~90% 완료, 내년 6월 종료 목표" -
2 압타바이오 “계열 내 최초 신약 'ABF-101' 20조 황반변성 주사 시장 흔든다” -
3 디앤디파마텍, “FDA의 AI 기반 MASH 조직 분석 도구 승인, DD01 임상 성공 청신호” -
4 상장 제약바이오 3Q 누적 평균 R&D비...전년비 코스피 7.0%, 코스닥 9.1%↑ -
5 노보 ‘위고비’ 7.2mg 고용량 제형 EU 허가권고 -
6 상장 제약바이오기업 3Q 누적 평균 상품매출...코스피 5.4%, 코스닥 10.7%↑ -
7 상장 제약바이오사 3Q 누적 평균 해외매출…전년비 코스피 20.6%, 코스닥 27.5%↑ -
8 디앤디파마텍 미국 관계사 '지알파' 출범..알파방사성 치료제 시장 공략 -
9 "팔아도 남는 게 없다"… 약가인하 칼바람에 벼랑 끝 몰린 중소제약사 -
10 파멥신, TIE2 타깃 항체 ‘PMC-403’ 1상 안전성 확보 성공
| 인터뷰 | 더보기 + |
| PEOPLE | 더보기 + |
| 컬쳐/클래시그널 | 더보기 + |

복지부, '경제적 이익 지출보고서' 양식 공식 공개
다음주 입법예고…현장의견 추가수렴 할 것
- 신은진 기자 ejshin@yakup.com
- 입력 2017.03.15 15:37 수정 2017.03.15 17:41

복지부는 15일 '경제적 이익 지출보고서 작성 의무화 제도 설명회'를 개최하고 보고서 작성양식과 세부내용에 대해 설명했다.
제약협회와 의협 등의 의견을 수렴해 수정·공개된 보고서양식은 당초 알려진 초안에 비해 관련 업계의 편의성을 고려한 조항들이 추가됐다. 견본품 제공, 임상시험 지원 등의 항목시 반드시 포함되어야 하는 의료인 서명을 기타 증빙자료로 확인가능하다면 생략가능하도록 한 것이다.
다만 최종안은 서명과 서명을 갈음할 수 있는 항목은 반드시 필요한 부분이라고 강조했다. 경제적 이익 지출보고서는 기업이 사적으로 관리하는 정보가 아닌 정부제출 보고서로써, 해당정보가 작성되지 않거나 허위기재된 경우 형사처벌이 이뤄질 수도 있기에 정보 기록자와 대상자의 쌍방 기록 차원에서 서명이 필요하다는 설명이다.
지출보고서 항목은 △견본품 제공 △임상시험 지원 △시판 후 조사 △제품설명회(복수/개별기관) △학술대회 지원 △대금결제 조건에 따른 비용할인으로 구성되어있다.
세부 항목은 다음과 같다.



임상시험 지원 양식의 경우 임상시험의 제목을 기재하는 방안에 대한 건의가 이뤄졌으나, 복지부는 경제적 이익 지출보고서의 작성 주체는 각각의 제약사이고 열람 주체는 복지부이기에 경쟁제약사가 열람할 우려가 없고 해당 정보는 이미 식약처에서 공개정보로 분류하고 있어 문제가 없다고 밝혔다.





학술대회 지원의 경우 실질적인 제공내역 확인이 가능한 수준으로 항목을 정했다는 설명이다. 다만 학회 특성상 직급 항목과 서명을 대체할 수 있는 증빙자료를 무엇으로 할 지에 대한 논의는 진행중이라고 밝혔다.

박재우 복지부 약무정책과 사무관은 "그간 정부의 정책이 단순히 메뉴얼로 지시하는 방식이었기에 이번에는 시행전 관계자들에게 직접 정부가 설명하는 것이 필요하다고 판단해 설명회를 진행하게 됐다"며 "오늘 공개한 양식은 아직 공식적으로 확정되지 않은 초안으로 다음주 입법예고를 통해 현장의견수렴을 진행, 최종안을 확정할 것이다"고 말했다.
Copyright © Yakup.com All rights reserved.
약업신문 의 모든 컨텐츠(기사)는 저작권법의 보호를 받습니다.
무단 전재·복사·배포 등을 금지합니다.
무단 전재·복사·배포 등을 금지합니다.



 기자가 쓴 기사 더보기
기자가 쓴 기사 더보기
