퀴아젠코리아,요로상피암 동반진단 유전자 검사 시약 '테라스크린 FGFR Kit' 국내 허가
입력 2022.11.25 10:07
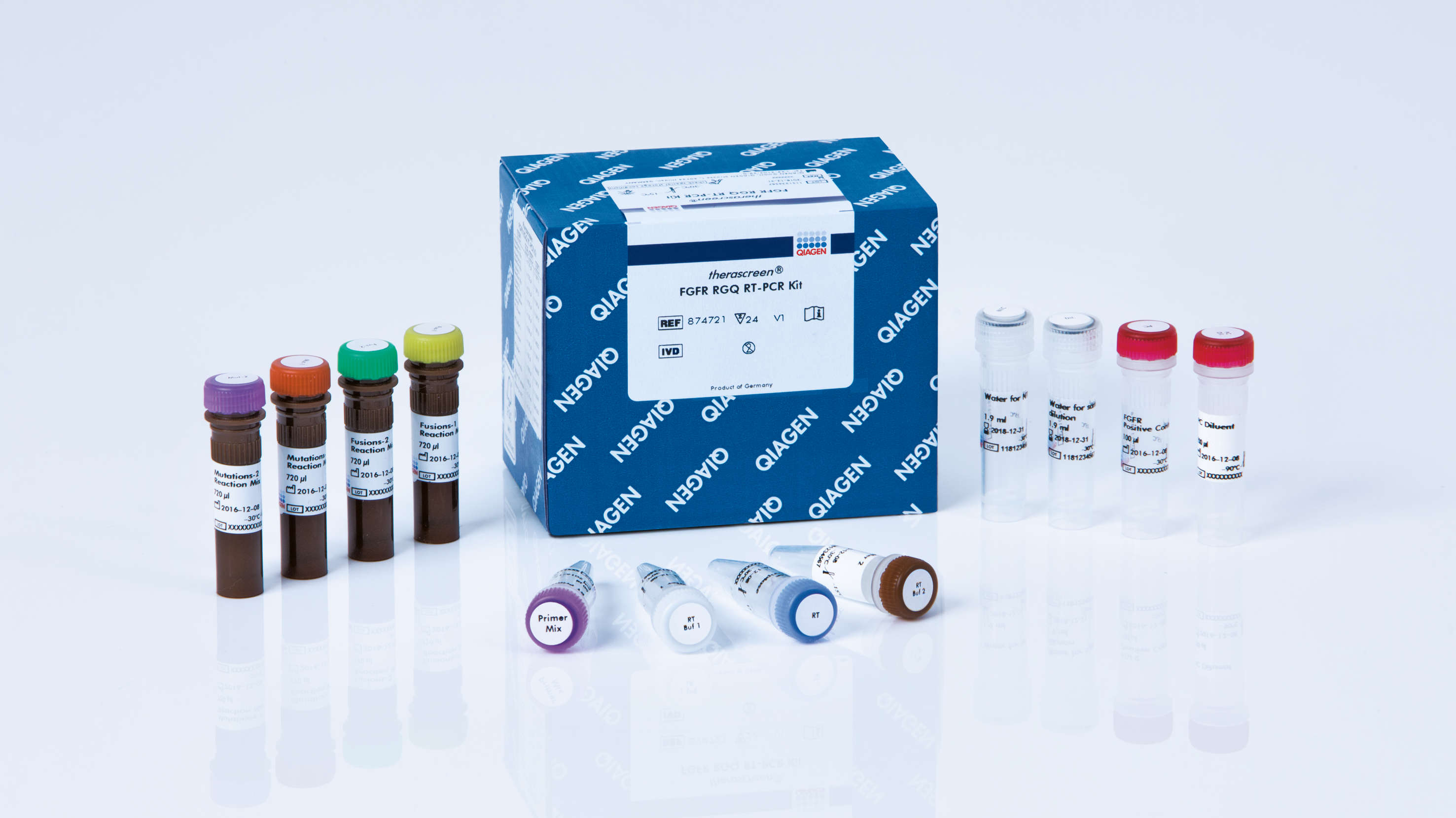
퀴아젠코리아 유한회사(대표 윌리엄 린)는 요로상피암 환자의 FGFR 3(섬유아세포 성장인자 수용체 3) 유전자 돌연변이를 검출할 수 있는 국내 최초의 동반진단 유전자 검사 시약인 테라스크린 FGFR Kit가 식품의약품안전처로부터 허가를 받았다고 25일 밝혔다.
테라스크린 FGFR Kit는 얀센이 새롭게 개발한 FGFR 키나아제 억제제인 발버사(성분명 얼다피티닙) 처방을 안내하기 위한 국내 유일의 체외진단 시약이다.
FGFR 3 유전자에 일정한 변이가 있는 요로상피암 환자를 진단하는 테라스크린 FGFR Kit는 성인 국소진행성 또는 전이성 방광암 환자를 대상으로 투여 가능한 발버사 처방에 적격한 환자를 선별할 수 있다. FGFR 유전자 돌연변이 동반진단 검사 시약으로는 처음으로 미국 식품의약국(FDA)의 허가를 받은 바 있다.
요로상피암은 방광과 기타 비뇨생식기에 있는 조직에서 시작되며, 90% 이상은 방광에서 발견되는 것으로 알려져 있다. 방광암은 세계에서 10번째로 흔히 발견되는 암으로 전 세계적으로 발병률이 꾸준히 증가하고 있다.
윌리엄 린 대표는 “이번 테라스크린 FGFR Kit허가로 요로상피암 환자들이 FGFR 3 유전자를 보다 정확하고 안전하게 검사하고 자신의 유전자 변이 상황에 맞게 보다 적절하고 효과적인 치료를 받을 수 있게 됐다”고 전했다.
테라스크린 FGFR Kit는 얀센이 새롭게 개발한 FGFR 키나아제 억제제인 발버사(성분명 얼다피티닙) 처방을 안내하기 위한 국내 유일의 체외진단 시약이다.
FGFR 3 유전자에 일정한 변이가 있는 요로상피암 환자를 진단하는 테라스크린 FGFR Kit는 성인 국소진행성 또는 전이성 방광암 환자를 대상으로 투여 가능한 발버사 처방에 적격한 환자를 선별할 수 있다. FGFR 유전자 돌연변이 동반진단 검사 시약으로는 처음으로 미국 식품의약국(FDA)의 허가를 받은 바 있다.
요로상피암은 방광과 기타 비뇨생식기에 있는 조직에서 시작되며, 90% 이상은 방광에서 발견되는 것으로 알려져 있다. 방광암은 세계에서 10번째로 흔히 발견되는 암으로 전 세계적으로 발병률이 꾸준히 증가하고 있다.
윌리엄 린 대표는 “이번 테라스크린 FGFR Kit허가로 요로상피암 환자들이 FGFR 3 유전자를 보다 정확하고 안전하게 검사하고 자신의 유전자 변이 상황에 맞게 보다 적절하고 효과적인 치료를 받을 수 있게 됐다”고 전했다.
오늘의 헤드라인
전체댓글 0개
등록된 댓글이 없습니다.
| 인기기사 | 더보기 + |
-
1 카나프테라퓨틱스,공모가 상단 2만원 확정…경쟁률 962.1대 1 -
2 알지노믹스, AACR서 간암 유전자치료제 ‘RZ-001’ 임상 중간결과 구두 발표 -
3 네이처셀, 조인트스템 미국 FDA 허가 추진 현황 등 설명 -
4 커지는 희귀질환 시장… 희귀질환 치료제 확대하는 한독 -
5 K-뷰티 구조적 성장 진행 중…2029년 150억 달러 규모 전망 -
6 약준모, 서울시의사회 '성분명처방' 옥외광고 복지부·공정위 고발 -
7 자동차보험 진료비 논의…"비용 통제보다 환자 보호 중심 접근 필요" -
8 화이자 CEO “FDA CBER 리더십 문제 있다” 공개 발언 -
9 컬럼비·프루자클라 암질심 통과…넥사바·스티바가 확대 불발 -
10 정부, 약가제도 개편 '속도조절론'에 선 긋기… "시행 시기 미정"
| 인터뷰 | 더보기 + |
| PEOPLE | 더보기 + |
| 컬쳐/클래시그널 | 더보기 + |

퀴아젠코리아,요로상피암 동반진단 유전자 검사 시약 '테라스크린 FGFR Kit' 국내 허가
- 이상훈 기자 jianhs@yakup.com
- 입력 2022.11.25 10:07

퀴아젠코리아 유한회사(대표 윌리엄 린)는 요로상피암 환자의 FGFR 3(섬유아세포 성장인자 수용체 3) 유전자 돌연변이를 검출할 수 있는 국내 최초의 동반진단 유전자 검사 시약인 테라스크린 FGFR Kit가 식품의약품안전처로부터 허가를 받았다고 25일 밝혔다.
테라스크린 FGFR Kit는 얀센이 새롭게 개발한 FGFR 키나아제 억제제인 발버사(성분명 얼다피티닙) 처방을 안내하기 위한 국내 유일의 체외진단 시약이다.
FGFR 3 유전자에 일정한 변이가 있는 요로상피암 환자를 진단하는 테라스크린 FGFR Kit는 성인 국소진행성 또는 전이성 방광암 환자를 대상으로 투여 가능한 발버사 처방에 적격한 환자를 선별할 수 있다. FGFR 유전자 돌연변이 동반진단 검사 시약으로는 처음으로 미국 식품의약국(FDA)의 허가를 받은 바 있다.
요로상피암은 방광과 기타 비뇨생식기에 있는 조직에서 시작되며, 90% 이상은 방광에서 발견되는 것으로 알려져 있다. 방광암은 세계에서 10번째로 흔히 발견되는 암으로 전 세계적으로 발병률이 꾸준히 증가하고 있다.
윌리엄 린 대표는 “이번 테라스크린 FGFR Kit허가로 요로상피암 환자들이 FGFR 3 유전자를 보다 정확하고 안전하게 검사하고 자신의 유전자 변이 상황에 맞게 보다 적절하고 효과적인 치료를 받을 수 있게 됐다”고 전했다.
테라스크린 FGFR Kit는 얀센이 새롭게 개발한 FGFR 키나아제 억제제인 발버사(성분명 얼다피티닙) 처방을 안내하기 위한 국내 유일의 체외진단 시약이다.
FGFR 3 유전자에 일정한 변이가 있는 요로상피암 환자를 진단하는 테라스크린 FGFR Kit는 성인 국소진행성 또는 전이성 방광암 환자를 대상으로 투여 가능한 발버사 처방에 적격한 환자를 선별할 수 있다. FGFR 유전자 돌연변이 동반진단 검사 시약으로는 처음으로 미국 식품의약국(FDA)의 허가를 받은 바 있다.
요로상피암은 방광과 기타 비뇨생식기에 있는 조직에서 시작되며, 90% 이상은 방광에서 발견되는 것으로 알려져 있다. 방광암은 세계에서 10번째로 흔히 발견되는 암으로 전 세계적으로 발병률이 꾸준히 증가하고 있다.
윌리엄 린 대표는 “이번 테라스크린 FGFR Kit허가로 요로상피암 환자들이 FGFR 3 유전자를 보다 정확하고 안전하게 검사하고 자신의 유전자 변이 상황에 맞게 보다 적절하고 효과적인 치료를 받을 수 있게 됐다”고 전했다.
Copyright © Yakup.com All rights reserved.
약업신문 의 모든 컨텐츠(기사)는 저작권법의 보호를 받습니다.
무단 전재·복사·배포 등을 금지합니다.
무단 전재·복사·배포 등을 금지합니다.



 기자가 쓴 기사 더보기
기자가 쓴 기사 더보기
